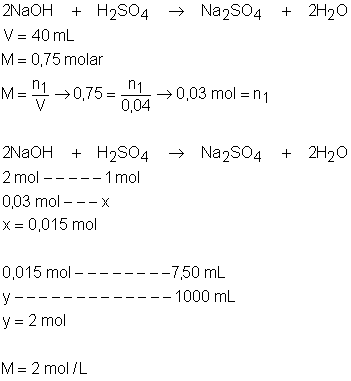Titulação – Exercícios Resolvidos
1.
Barrilha, que é carbonato
de sódio impuro, é um insumo básico da indústria química. Uma amostra de barrilha de
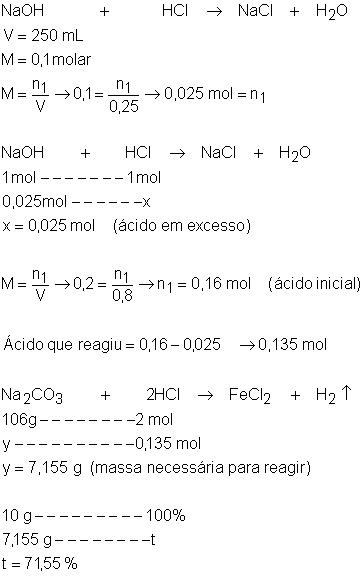
2.
1,24g de ferro
impuro foi dissolvido em 20 mL de HCl 3 molar, produzindo cloreto ferroso e hidrogênio.
Após essa reação, o excesso de HCl foi neutralizado por 10 mL de NaOH 2 molar. Qual é a
porcentagem de pureza do ferro analisado?
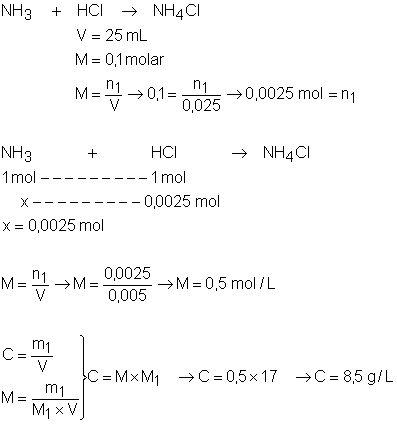
3.
O rótulo de um
produto de limpeza diz que a concentração de amônia (NH3) é de 9,5 g/L. Com o intuito de verificar se a concentração de amônia
corresponde à indicada no rótulo, 5 mL desse produto
foram titulados com ácido clorídrico (HCl) de
concentração 0,1 mol/L. Para consumir toda a amônia dessa amostra, foram gastos
25 mL do ácido. Qual a concentração, em g/L, da solução,
calculada com os dados da titulação?
4.
25g de hidróxido
de sódio (NaOH) impuro são
dissolvidos em água suficiente para 500 mL de
solução. Uma alíquota de 50 mL dessa solução gasta,
na titulação, 25 mL de ácido sulfúrico (H2SO4)
1 molar. Qual é a porcentagem de pureza do hidróxido de sódio?
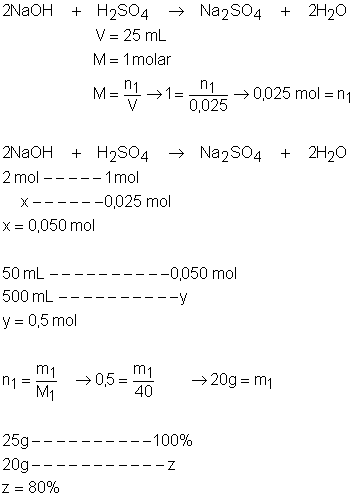
5.
O metal X reage
com ácido clorídrico de acordo com a equação balanceada: X + 3HCl
--> X+3 + 3Cl- + 3/2H2.
Considerando que 500 mL de uma solução 3M de ácido
clorídrico reagem completamente com 26,0g desse metal, calcule a massa atômica
de X.
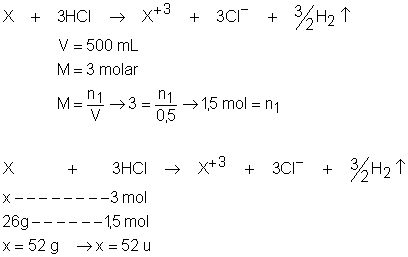
6.
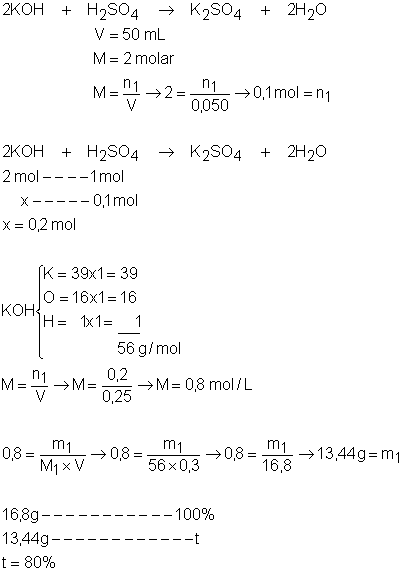
Uma amostra
impura de hidróxido de potássio (KOH), com massa igual a 16,8g foi dissolvida
em água até obter-se 300 mL de solução. Uma amostra
de 250 mL desta solução foi neutralizada totalmente
por 50 mL de H2SO4 2 molar. Admitindo que as
impurezas não reagem com ácido, determine a
molaridade da solução de KOH e o teor de pureza do hidróxido de potássio.
7.
0,195g de um metal bivalente foi dissolvido em 10 mL de ácido sulfúrico 0,50 molar. O excesso de ácido foi
neutralizado por 16 mL de hidróxido de potássio 0,25
molar. Calcule a massa atômica do metal.
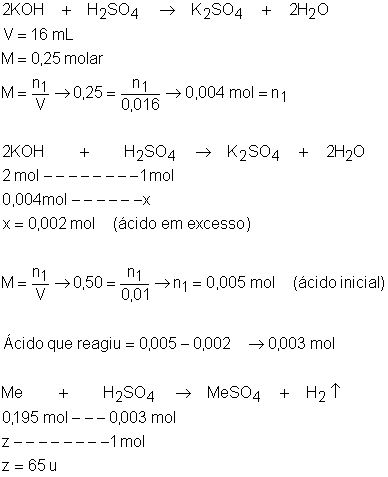
8.
Para realizar a
titulação de 20 mL de hidróxido de sódio (NaOH) de molaridade desconhecida,
foram utilizados 50 mL de ácido sulfúrico (H2SO4)
0,2 molar. Qual a molaridade do hidróxido de sódio?
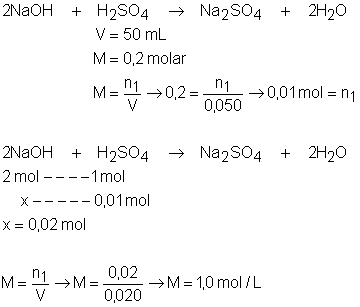
9.
Por lei, o
vinagre (solução aquosa de ácido acético) pode conter, no máximo, 4% em massa
de ácido acético (M = 0,67 mol/L). Suponha que você queira verificar se o
vinagre utilizado em sua casa atende as especificações legais. Para isso, você
verifica que 40 mL de vinagre são completamente
neutralizados por 15 mL de uma solução aquosa de hidróxido
de sódio 2,0 molar. A que conclusão você chega?
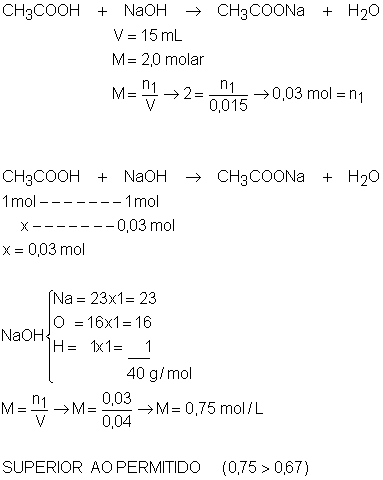
10. Qual o volume de Mg(OH)2
0,4 molar necessário para neutralizar 80 mL de ácido
clorídrico (HCl) 1,5 molar?
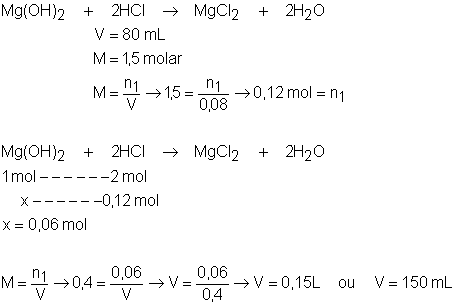
11. Um estudante verifica que 20 mL
de hidróxido de potássio (KOH) 0,3 molar são necessários para neutralizar uma
amostra de 30 mL de ácido clorídrico (HCl). Determine a molaridade do HCl.
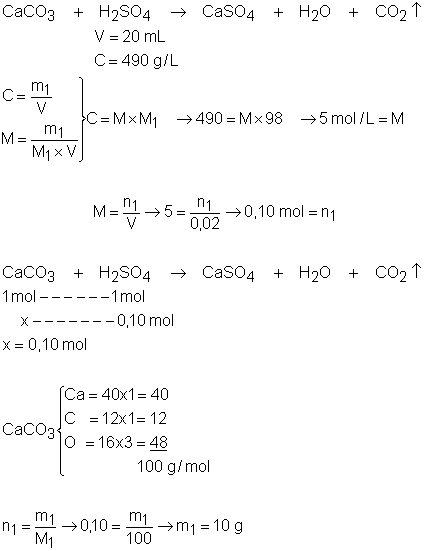
12. Que massa de carbonato de cálcio (CaCO3)
é necessária para neutralizar 20 mL de ácido sulfúrico
(H2SO4) de concentração 490 g/L?
13. Qual a massa de ácido fórmico (HCOOH), que,
dissolvida em 500 mL de água, resulta em uma solução
que é completamente neutralizada por 500 mL de uma
solução de hidróxido de sódio (NaOH)
1 molar?
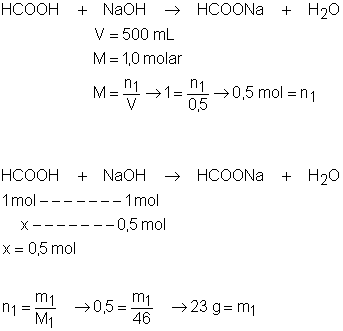
14.
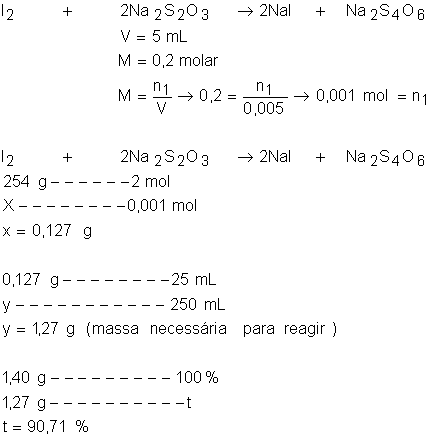
15. 0,3g de cloreto de cálcio (CaCl2)
impuro é dissolvido em água e a solução é titulada, gastando 25 mL de oxalato de sódio (Na2C2O4)
0,1 molar. Qual é a porcentagem de pureza do cloreto de cálcio?
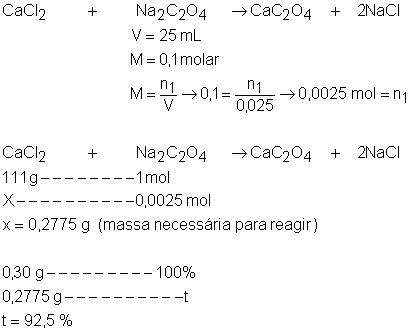
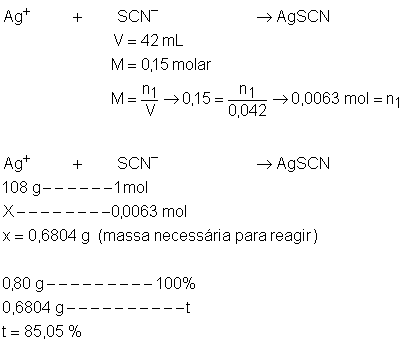
16. Para determinar a porcentagem de prata em uma liga,
um analista dissolve uma amostra de 0,8g da liga em ácido nítrico (HNO3).
Isso causa a dissolução da prata como íons Ag+.
A solução é diluída com água e titulada com uma solução 0,15 molar de tiocianato de potássio (KSCN). É formado, então, um
precipitado: Ag+ + SCN- àAgSCN. E o analista descobre que são necessários 42 mL de solução de KSCN para a titulação. Qual é a
porcentagem em massa de prata na liga?
17.
18. Para sua completa neutralização, uma amostra de
vinagre de 5,0 mL consumiu 25 mL
de uma solução que contém 0,20 mol/L de hidróxido de
sódio. Supondo que o único componente ácido do vinagre seja o ácido acético (H3CCOOH),
calcule a massa, em gramas, do ácido contida em
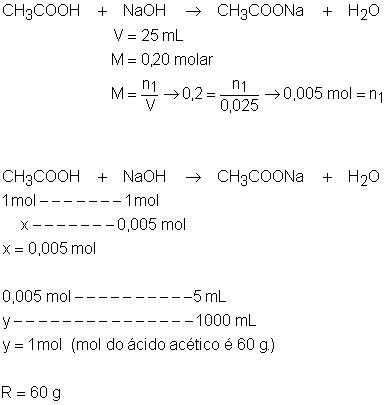
19. O eletrólito empregado em baterias de automóvel é uma
solução aquosa de ácido sulfúrico. Uma amostra de 7,50 mL
da solução de uma bateria requer 40,0 mL de hidróxido
de sódio