

É a parte da Química que estuda as variações de energia que acompanham as reações químicas.
Entalpia de um sistema (H): pode ser conceituada como o conteúdo energético do sistema. A variação de entalpia é medida nas transformações químicas, utilizando a seguinte fórmula: DH= Hp – Hr, sendo que Hp é a entalpia dos produtos e Hr é a entalpia dos reagentes.
Classificações das reações
Reação exotérmica: É aquela que libera calor ou é aquela em que o calor é considerado "produto" da reação. A variação de entalpia, (DH), tem sinal trocado em relação ao calor do produto e o Q > 0.
A entalpia dos produtos é menor que a dos reagentes, ou seja, apresenta D H<0. Pode ser representada de várias formas:

Veja que o sinal do D H é igual ao calor do primeiro membro e contrário ao do segundo membro, quando vem na própria reação.
|
|
E1= energia dos reagentes (r) E2= energia do complexo ativado (CA) E3= energia dos produtos (p) b=energia de ativação da reação direta c=variação de entalpia (D H= Hp – Hr)
|
Reação endotérmica
: É aquela que absorve calor ou é aquela em que o calor é considerado "reagente".A entalpia dos produtos é maior que a dos reagentes, ou seja, apresenta D H>0. Pode ser representada de várias formas:

Veja que o sinal do DH é igual ao calor do primeiro membro e contrário ao do segundo membro, quando vem na própria reação.
|
|
E1= energia dos reagentes (r) E2= energia do complexo ativado (CA) E3= energia dos produtos (p) b=energia de ativação da reação direta c=variação de entalpia (D H= Hp – Hr)
|
Calor de reação ou energia de reação: é a energia térmica liberada ou absorvida em uma reação. O calor de reação mede a diferença de energia entre os reagentes e os produtos, desde que as substâncias iniciais e finais estejam, todas à mesma temperatura e à mesma pressão.
Calor de combustão: é a variação de calor que ocorre na combustão de 1 mol de substância a 25ºC e 1 atm de pressão.
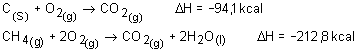
|
|
|||
|
Substância |
Fórmula |
kcal/mol |
kJ/mol |
|
Acetileno |
C2H2(g) |
-310,6 |
-1299,6 |
|
Ácido etanóico |
H3C-COOH(L) |
-208,5 |
-872,4 |
|
Benzeno |
C6H6(L) |
-781,0 |
-3267,7 |
|
Butano |
C4H10(g) |
-688,0 |
-2878,6 |
|
Etano |
C2H6(g) |
-372,8 |
-1599,8 |
|
Etanol |
H3C-CH2-OH(L) |
-326,5 |
-1366,1 |
|
Eteno |
C2H4(g) |
-337,2 |
-1410,8 |
|
Glicose |
C6H12O6
(S) |
-673,0 |
-2815,8 |
|
Grafita |
C(s) |
-94,1 |
-393,3 |
|
Hidrogênio |
H2(g) |
-68,3 |
-285,8 |
|
Metano |
CH4(g) |
-212,8 |
-890,4 |
|
Metanol |
H3C-OH(L) |
-173,6 |
-726,3 |
|
Monóxido de carbono |
CO(g) |
-67,6 |
-282,8 |
|
Propano |
C3H8(g) |
-530,6 |
-2220,0 |
|
Sacarose |
C12H22O11
(S) |
-1348,9 |
-5643,8 |
Calor de neutralização: é o calor da reação de neutralização de um equivalente-grama de um ácido ou um equivalente-grama de uma base. Para soluções aquosas diluídas, verifica-se que o calor de neutralização de ácidos fortes com bases fortes é aproximadamente 13,7 kcal.
![]()
A constância do valor da variação de entalpia não é assim tão surpreendente, porque, quando ácidos e bases fortes estão suficientemente diluídos, a reação que ocorre é apenas de H+ com OH-.
Evidentemente que, em se tratando de ácidos e bases fracos, o grau de ionização (a) já não se aproxima dos 100% e o valor do DH foge do valor previsto.
Calor de formação:a a quantidade de calor libertada ou absorvida na síntese total de um mol dessa substância a partir de seus elementos no estado padrão.
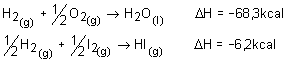
|
Energia de formação
|
|
|
Substância |
|
|
Br2(G) |
+30,7 |
|
C2H2(G) |
+226,8 |
|
C2H4(G) |
+53,3 |
|
C2H4O2(L) |
-487,3 |
|
C2H5OH(L) |
-277,8 |
|
C2H6(G) |
-84,7 |
|
C3H8(G) |
-110,2 |
|
C4H10(G) |
-126,4 |
|
C6H6(L) |
+82,9 |
|
CH4(G) |
-74,8 |
|
CO(G) |
-110,5 |
|
CO2(G) |
-393,8 |
|
H2O(G) |
-241,9 |
|
H2O(L) |
-286,0 |
|
H2S(G) |
-20,1 |
|
H2SO4(G) |
-811,8 |
|
H3COH(L) |
-238,7 |
|
HBr(G) |
-36,2 |
|
HCHO(G) |
-115,9 |
|
HCl(G) |
-92,3 |
|
HF(G) |
-268,7 |
|
HI(G) |
+25,9 |
|
HNO3(L) |
-173,3 |
|
N2O(G) |
+81,6 |
|
N2O3(G) |
+83,7 |
|
N2O4(G) |
+9,6 |
|
N2O5(G) |
+15,0 |
|
NH3(G) |
-46,2 |
|
NH4Cl(S) |
-315,6 |
|
NO(G) |
+90,4 |
|
NO2(G) |
+33,8 |
|
NOCl(G) |
+52,6 |
|
O3(G) |
+142,3 |
|
PCl3(G) |
-306,5 |
|
PCl5(G) |
-399,2 |
|
SO2(G) |
-297,0 |
|
SO3(G) |
-395,4 |
Entalpia Padrão (DH)
A entalpia de uma substância simples, a 1 atm e 25ºC e no estado e forma alotrópica mais estáveis, é considerada igual a zero.
Entalpia de uma substância composta: é a entalpia de formação dessa substância a 1 atm e 25ºC, partindo-se de substância simples no estado e forma alotrópica mais comuns.
Exercício resolvido
Calcular a variação de entalpia na reação: CH4 + 2O2 à CO2 + 2H2O, utilizando as entalpias de formação, em kcal/mol: CH4=–17,9; CO2=–94,1 e H2O=–68,3.
Resolução:

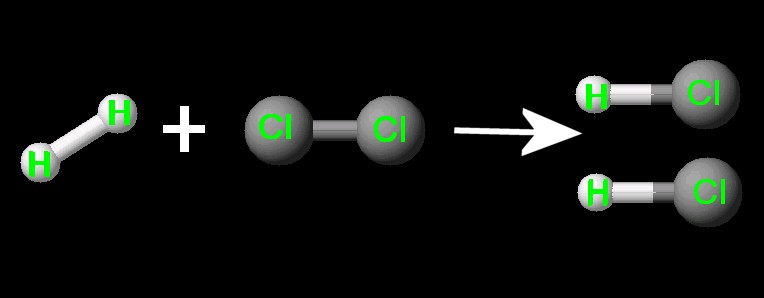
Energia de ligação:é a energia necessária para romper um mol de ligações quando se obtêm os átomos isolados no estado gasoso.
A principal aplicação prática é permitir o cálculo da variação de entalpia de reações, conhecendo-se as energias de ligações.
Veja esse exemplo, reagindo gás hidrogênio e cloro, formando cloridreto.

|
|
||
|
|
kcal/mol |
kJ/mol |
|
Br -
Br |
46,1 |
192,8 |
|
C -
Br |
67,1 |
280,7 |
|
C -
C |
82,9 |
346,8 |
|
C -
Cl |
78,2 |
327,2 |
|
C -
F |
103,8 |
434,3 |
|
C
-
H |
98,8 |
413,4 |
|
C - I |
57,7 |
241,4 |
|
C
-
O |
84,5 |
353,5 |
|
C
= C |
146,8 |
614,2 |
|
C
= O |
192,1 |
804,3 |
|
C
º
C |
199,2 |
833,4 |
|
Cl
-
Cl |
58,0 |
242,6 |
|
F -
F |
36,6 |
153,1 |
|
H - Br |
87,5 |
366,1 |
|
H - Cl |
103,2 |
431,8 |
|
H - F |
134,6 |
563,2 |
|
H - H |
104,2 |
436,0 |
|
H - I |
71,4 |
298,7 |
|
H - O |
110,8 |
463,5 |
|
I - I |
36,1 |
151,0 |
|
N
-
Cl |
46,0 |
192,6 |
|
N
-
F |
65,0 |
272,1 |
|
N
-
H |
93,4 |
391,0 |
|
N º N |
225,8 |
945,4 |
|
O
-
O |
33,2 |
138,9 |
|
O
= O |
119,1 |
468,6 |
Lei de Hess : Germain Henri Hess (1802 - 1850), médico e químico que, apesar de nascido na Suíça, passou toda a sua vida na Rússia, é considerado um precursor da Termoquímica. Entre inúmeros trabalhos nesta área, Hess determinou em 1840 a seguinte lei: "A variação de entalpia envolvida numa reação química, sob determinadas condições experimentais, depende exclusivamente da entalpia inicial dos reagentes e da entalpia final dos produtos, seja a reação executada em uma única etapa ou em várias etapas sucessivas".
Dessa forma, podemos pensar que a variação de energia térmica em um processo químico é a mesma, se o processo se realiza em um ou em diversos estágios, pois a variação de energia depende somente das propriedades das substâncias nos estados inicial e final.

Essa lei é muito útil para determinar indiretamente calor de reação, impossível de ser medido experimentalmente. O calor total liberado ou absorvido nas reações sucessivas: Aà B e Bà C é igual ao calor liberado ou absorvido na reação A à C.
Outra maneira de dizer a mesma coisa é que o calor liberado ou absorvido na reação A à C não depende do número de estados intermediários.
Essa constatação é importante porque permite trabalhar com equações químicas como se fossem equações matemáticas, isto é, permite calcular o DH de uma determinada reação x (incógnita) pela soma de reações de DH conhecidos, cujo resultado seja a reação de x.
Lembre-se
de que, ao multiplicar ou dividir os coeficientes de uma reação termoquímica
por um número qualquer, deve-se multiplicar ou dividir o valor de DH
desta reação pelo mesmo número.
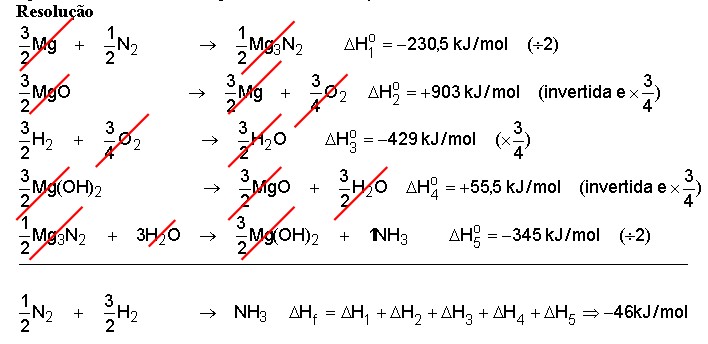
Deseja-se determinar o calor de formação da amônia gasosa.
![]()
São conhecidas as seguintes reações:
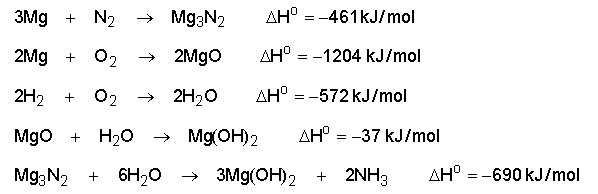
Resolução
Energia de ativação
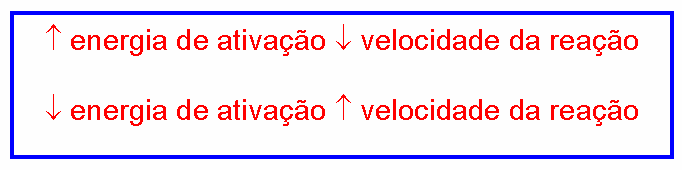
A energia de ativação deve ser entendida como uma dificuldade para ocorrer a reação. Dessa forma, quanto maior for a energia de ativação, mais difícil será para a reação acontecer. São reações que necessitam que se forneça muita energia para que ocorram: são reações lentas.
Quanto menor a energia de ativação, mais fácil será para a reação acontecer. São reações que necessitam de pouca energia para que ocorram: são reações rápidas.
|
Exercícios resolvidos |
Indique os números que representam a variação de entalpia e a energia de ativação da reação direta.§
Resposta: Reação direta é a reação da esquerda para a direita. Dessa forma, A é o reagente e B é o produto. A energia de ativação da reação direta é o 2 e variação de entalpia, o 4.
Considerando o gráfico, responda os números que correspondem a variação de entalpia e a energia de ativação da reação inversa.§

Resposta: Reação inversa é a reação da direita para a esquerda. Dessa forma, o B é o reagente e o A é o produto. O 5 é a energia de ativação da reação inversa e a variação de entalpia é representada pelo 4.
Considere os seguintes processos: neutralização de leite de magnésia no estômago, oxidação de cobre, formando zinabre e ataque de ácido muriático (HCl) em pedaço de palha de aço. Quem apresenta alta energia de ativação?§
Resposta: Ter alta energia de ativação significa velocidade baixa, ou seja, reação muito lenta. Isso quer dizer que somente a oxidação do cobre formando zinabre apresenta, pois é uma reação lenta. Já os dois outros processos apresentam energia de ativação baixa, o que significa uma reação rápida.
§
A combustão do gás de cozinha é uma reação exotérmica, porém só se inicia ao receber energia externa como, por exemplo, a da chama de um palito de fósforo. Como é chamada a energia fornecida pelo palito?Resposta: A energia fornecida pelo palito é aquela necessária para iniciar a reação. Recebe o nome de energia de ativação.
§
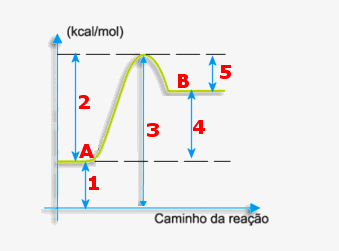
Observe o diagrama de energia e julgue as afirmativas:
I- O processo é exotérmico;
II- A reação tem variação de entalpia igual a –30 kcal
III- A energia de ativação vale +130 kcal
IV- O valor do complexo ativado é +90 kcal
Resposta:
I-F O processo é endotérmico, pois a energia dos produtos (40) é maior que a dos reagentes (10);
II-F A variação de entalpia é de +30 kcal, ou seja, 40-10;
III-F A energia de ativação é 80 kcal, pois inicia em 10 kcal (entalpia dos reagentes) e vai até 90 kcal (complexo ativado);
IV-V O complexo ativado é o ápice da curvatura do gráfico (90 kcal)
§
Considere o gráfico da reação e responda os quesitos a seguir:
a)Qual a energia das moléculas reagentes e a das moléculas dos produtos?
R: A entalpia dos reagentes é 21 kcal e a dos produtos é 13 kcal. Na reação direta, sempre quem está encostado no eixo é o reagente.
b)Qual a energia de ativação?
R: Ela inicia na entalpia dos reagentes e vai até o ápice da curvatura (complexo ativado). Nesse caso, ela vai de 21 a 38, o que indica que é +17 kcal.
c)Qual o tipo da reação em questão? Por quê?
R: O tipo da reação depende da variação de entalpia, que é calculada pela entalpia dos produtos menos a entalpia dos reagentes (D H=Hp-Hr). Nesse caso, ela é exotérmica, pois terá como resultado, o valor de –8 kcal. Isso indica que ela liberou energia, pois o sistema perdeu energia. Havia iniciado com 21 e terminou com 13, o que indica uma liberação de 8 kcal.
d)Qual a energia liberada ou absorvida pela reação?
R: Conforme o quesito anterior, ela foi liberada pelo sistema na quantidade de 8 kcal.
Em caso de dúvidas, escreva para Prof. João Neto