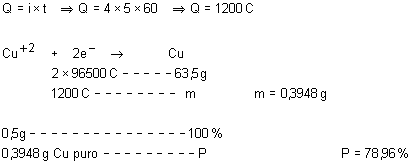Corrente
elétrica (i): é a carga elétrica que atravessa a seção
transversal de um circuito dividida pelo intervalo de tempo. A unidade do SI
usada para expressar corrente elétrica é o ampère, simbolizado por A,
definido como C/s (Coulomb por segundo). Dessa forma, dizer que uma corrente de
1 A passa por um circuito significa dizer que a carga de 1C passa por ele num
intervalo de 1s. O aparelho utilizado para medir a corrente elétrica é o amperímetro,
que fornece o resultado da medida em ampères. O amperímetro mede, portanto,
quantos coulombs de carga passam por ele a cada segundo. Para saber a carga elétrica
que atravessa um circuito durante certo tempo, basta multiplicar a corrente elétrica
(em A) pelo intervalo de tempo (em s), ou seja,![]() .
.
Em
1909, o físico americano Millikan determinou que a carga elétrica de um elétron
é igual a 1,6x10-19C. Como sabemos que um mol de elétrons
corresponde a 6,02x1023 e-, a quantidade de carga
transportada pela passagem de um mol de elétrons é dada pelo produto entre
esses dois valores, ou seja: 1,6x10-19 x 6,02x1023 =
9,65x104C ou 96500C (quantidade de carga transportada por um mol de
elétrons, denominada Constante de Faraday (1F).
Quando
se conhece a quantidade de carga fornecida em uma eletrólise, é possível
prever a quantidade (massa, mol, etc) de substâncias que serão produzidas
nesse processo. Com isso é possível definir a 1ª e 2ª lei de Faraday:
1ª
lei à A massa que se forma em um eletrodo é diretamente proporcional à
quantidade de carga que atravessa o circuito. Logo: m=k.Q
m= massa de substância produzida; k= constante de
proporcionalidade; Q= quantidade de carga em C
2ª
lei àA massa que se forma em um eletrodo é diretamente proporcional ao
equivalente de oxi-redução da substância. Logo: m=k.E
m= massa de substância produzida; k= constante de
proporcionalidade; E= equivalente de oxi-redução.
Equivalente
de oxi-redução: É a massa de um elemento que
perde ou ganha um mol de elétrons. Veja o exemplo: 1 mol do metal cobre (Cu)
perde 2 moles de elétrons e forma um mol de cátions bivalentes (Cu+2),
conforme o processo : Cu
à Cu+2
+ 2e-
1mol
2mols
![]() à
Dessa
forma, teremos para o cobre o seguinte raciocínio: considerando que a massa
molar do Cu é 63,5 e que o Nox é +2, então:
à
Dessa
forma, teremos para o cobre o seguinte raciocínio: considerando que a massa
molar do Cu é 63,5 e que o Nox é +2, então:
![]()
Levando em consideração o enunciado das duas leis de Faraday, a massa de substância produzida em um eletrodo poderá ser calculada por meio das seguintes relações:
![]()
Equivalente eletroquímico (Eq):
é a quantidade de substância eletrolisada ou depositada, quando se faz passar
uma carga de 1 C na solução.
![]()
Cubas em série:
Sabendo-se que 1F eletrolisa 1E, quando o circuito for em série, poderemos
concluir que, como a carga que circulará para cada eletrodo será a mesma para
todos os eletrodos, o número de equivalentes formado será o mesmo em todos os
eletrodos.
Como
a carga que passa nos eletrodos é a mesma:
![]()
Isso
também pode ser aplicado às pilhas. O número de equivalentes que aparece no cátodo
é igual ao que desaparece no ânodo.
1.
Calcular o tempo, em segundos, necessário para que uma corrente de
intensidade igual a 19,3 A libere 4,32g de prata no cátodo. R=200s
2.
Calcule o volume de hidrogênio liberado a 27OC e 700 mmHg
pela passagem de uma corrente de 1,6 A durante 5 min por uma cuba contendo hidróxido
de sódio.
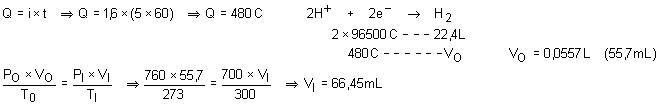
3.
Determine qual a intensidade de corrente que o gerador deve fornecer para
que, depois de 9650 s de passagem de corrente elétrica por uma solução de
sulfato de cobre II – CuSO4 sejam liberados 6,35g de cobre no cátodo.
R=2A
4.
Na reação
![]() , a participação de 1 mol de elétrons
fornecerá qual volume de gás hidrogênio , medido nas CNTP?
, a participação de 1 mol de elétrons
fornecerá qual volume de gás hidrogênio , medido nas CNTP?
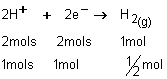
1
mol -------------22,4 L
½
mol -------------V à
V=11,2 L
5.
Uma peça de bijuteria recebeu um banho de prata (prateação) por meio
de um processo eletrolítico. Sabendo-se que nessa deposição o Ag+
reduz-se a Ag e que a quantidade de carga envolvida no processo é de 0,01F,
qual é a massa de prata depositada?
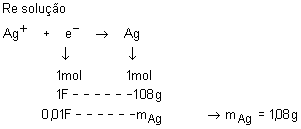
6. Quantos mols de gás cloro se formarão pela passagem de 1 faraday na eletrólise aquosa de cloreto de sódio? R=0,5
7. Qual a massa de sódio metálico produzido durante a eletrólise ígnea do cloreto de sódio – NaCl, após a passagem de uma quantidade de carga igual a 5F? R=115g
Qual a massa de ferro depositada no cátodo de uma célula eletrolítica, contendo solução aquosa de cloreto férrico (FeCl3), quando através dela passa uma carga de 0,1F? R=1,86g
Qual a massa de prata liberada pela passagem de uma corrente de 0,5 A durante cinco minutos, numa solução de nitrato de prata – AgNO3? R=0,17g
10.
Na eletrólise de uma solução aquosa de sulfato cúprico (CuSO4),
tem-se a seguinte reação:
Cu+2
+ 2e- à
Cu. Quantos moles de íons Cu+2 são reduzidos por uma quantidade de
eletricidade igual a 1F? R=0,5 mol
11.
(Unicamp-SP) O cobre metálico, para ser utilizado como condutor elétrico,
precisa ser muito puro, o que se consegue por via eletrolítica. Neste processo
os íons Cu+2 são reduzidos no cátodo a cobre metálico. Qual a
massa de cobre que se obtém por mol de elétrons que atravessa a cuba eletrolítica?
R=31,75g
Qual a corrente elétrica
necessária para que, em 965s, ocorra a redução Ag+ + 1e- àAg?
R=10 A
13.
Determinar a massa de Zn que se deposita na eletrólise de uma solução
de ZnCl2 , durante 16 min 5 segundos, com uma corrente elétrica de
0,5A.
14.
Numa pilha de flash antiga, o eletrólito está contido numa lata
de zinco que funciona como um dos eletrodos. Que massa de zinco é oxidada a Zn+2
durante a descarga desse tipo de pilha, por um período de 30 minutos,
envolvendo uma corrente de 5,36x10-1 A?
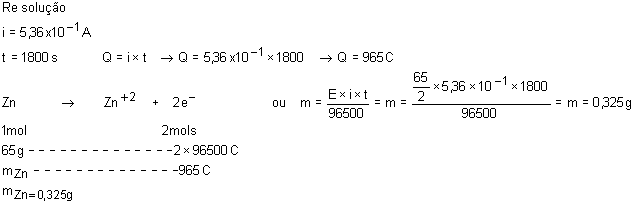
15.
Qual o tempo necessário para obtermos 3,175g de cobre a partir de uma
solução de CuSO4, sabendo que a corrente elétrica é de 100A ?
16.
Determinar o equivalente-grama de uma substância formada em um eletrodo,
sabendo que, ao passar uma corrente de 9,65A de intensidade durante 8 minutos e
20 segundos, formam-se 1,4g de substância.
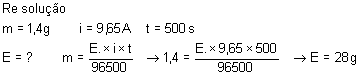
Qual a massa de prata metálica
que irá se depositar ao se passar por uma solução aquosa de cloreto de prata
(AgCl) uma corrente elétrica de 4A durante um tempo de 30 minutos?
R=8,058g
18.
Calcule a massa de prata que se deposita no cátodo quando se faz passar
uma corrente elétrica de 10A por uma solução de nitrato de prata – AgNO3,
durante 20 minutos.
Calcule a massa de cobre metálico
depositada por uma corrente elétrica de 1,93A que atravessa uma solução de
sulfato cúprico (CuSO4) durante 10 min?
R=0,381g
20. Qual
é a quantidade de eletricidade obtida em uma pilha de Daniell pela oxidação
de 0,2612g de zinco? Qual a intensidade da corrente produzida, sabendo-se que a
pilha funcionou durante 25 minutos e 44 segundos? Dado= Zn=65,3u
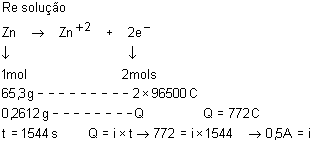
21.
Em uma eletrólise em série, temos em uma célula eletroquímica solução
de nitrato de prata - AgNO3 e, na outra, solução de sulfato cúprico
- CuSO4. Sabendo que na primeira cela eletroquímica há deposição
de 21,6g de prata no cátodo, calcular a massa de cobre depositada na outra cela
eletroquímica.
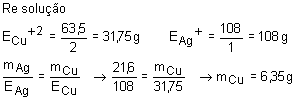
Qual a massa de metal
depositada, quando uma corrente de 10A atravessa uma solução de nitrato de
prata (AgNO3), durante 16 min 5s? R=10,8g
23.
Calcular os potenciais das soluções de FeSO4 nas concentrações
abaixo, considerando que o potencial padrão de oxidação (EOXI) do
ferro é +0,44V.
a)0,1M
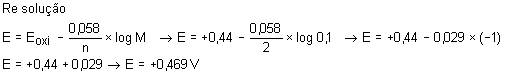
b)0,01M
c)0,001M
24.
Duas células eletroquímicas, ligadas em série, contém
respectivamente, soluções aquosas de NiCl2
e CuSO4. Após certo tempo de eletrólise houve depósito de
50,8g de cobre. Qual a massa de níquel depositada na outra célula eletroquímica?
25.
Calcule os potenciais da solução de carbonato de alumínio - Al2(CO3)3
com concentração 0,001M, considerando que o potencial de oxidação do alumínio
é +1,67.
26.
Duas células eletrolíticas, contendo soluções de sulfato de
alumínio - Al2(SO4)3
e de sulfato de zinco - ZnSO4, respectivamente, estão ligadas em série.
A primeira delas deposita 3g de alumínio. Qual a massa de zinco depositada na
segunda, durante o mesmo tempo?
27.
Tem-se três cubas eletrolíticas ligadas em série, contendo
respectivamente AgNO3, CuSO4 e ZnCl2.
Sabendo-se que na primeira cuba foram depositados 108g de prata metálica, qual
a massa de cobre e zinco depositadas nas outras cubas?
28.
A passagem de corrente elétrica por duas cubas ligadas em série,
contendo, respectivamente, KBr e NaCl em fusão ígnea, propicia a formação de
5g de potássio na primeira cuba. Determine a massa de sódio obtida na segunda
cuba. R=2,94g
29.
Um sal de um metal de peso atômico 196,99 foi eletrolisado durante cinco
minutos por uma corrente de 3,86 A, fornecendo um depósito de 0,788g do metal
no cátodo. Pelos dados, qual o número de oxidação do metal no sal? R=+3
30.
Um rádio de pilha ficou ligado durante a partida de um jogo de futebol.
Nesse período sua cápsula de zinco sofreu um desgaste de 0,3275g tendo
originado uma corrente de 0,3216 A. Qual
foi a duração da narração do jogo, em minutos? Considere a massa atômica do
zinco igual a 65,5u.
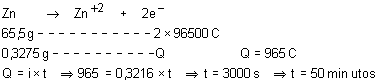
31.
No cátodo de uma cuba eletrolítica contendo solução de Cr+3,
adaptou-se uma peça de automóvel para ser cromada. Durante 9650s, passou-se
uma corrente de três ampères. Calcule o aumento da massa (em gramas) da peça.
R=5,2g
32.
Considerando a massa atômica do níquel igual a 59 u, qual a massa de níquel
obtida no cátodo a partir de uma solução de cloreto de níquel II, submetida
a uma corrente elétrica de 20 A durante 2 horas? R=44,02g
33.
Em uma cuba eletrolítica, utilizou-se uma corrente de 3 A para se
depositar toda a prata existente em 400 mL de uma solução 0,1M de nitrato de
prata. Com base nos dados acima, qual o tempo necessário para realizar a operação
descrita, em segundos.
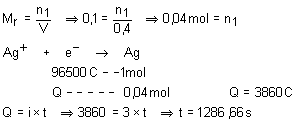
34.
Qual o tempo, em horas, durante o qual deverá passar uma corrente de
9,65 A através de uma solução de cloreto de ferro II – FeCl2
para que se depositem 10,08g de ferro metálico? R= 1 h
35.
Eletrolisando-se, durante cinco minutos, a solução de sulfato de cobre
II com uma corrente elétrica de 1,93 A, verificou-se que a massa de cobre metálico
depositada no cátodo foi de 0,18g. Em função dos valores apresentados acima,
qual o rendimento do processo?
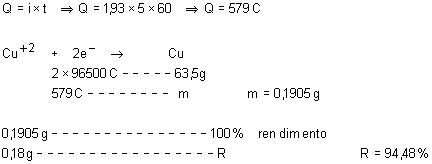
36.
Numa célula eletrolítica contendo solução aquosa de nitrato de prata
flui uma corrente elétrica de 5,0 A durante 9650s. Nessa experiência, quantos
gramas de prata metálica são obtidos? R= 27g
37.
0,5g de cobre comercial foi “dissolvido” em ácido nítrico, conforme
a reação a seguir:
![]()
e a solução resultante foi eletrolisada até deposição total do cobre, com
uma corrente de 4,0 A em 5 min. Qual é a pureza desse cobre comercial?