

Estudos Avançados em Propriedades Coligativas
Fator
de Van't Hoff è
i=1+a(q-1)
01.
Calcular o fator de Van't Hoff
do sulfato de sódio (Na2SO4), sabendo que o seu grau de
ionização é de 90%.
Dado: Na2SO4 è
2Na+ + 1SO4-2
R: 2,8
02.
Calcular o fator de Van't Hoff
do sulfato de alumínio - Al2(SO4)3 , sabendo
que o seu grau de ionização é de 75%.
Dado: Al2(SO4)3 è
2Al+3 + 3SO4-2
R:4
03.
O H3PO4
apresenta grau de ionização igual a 27%.
Calcule o fator de Van't Hoff.
Dado: H3PO4 è
3H+ + 1PO4-3
R: 1,81
04.
Determine o fator de Van’t
Hoff para o NaCl (a=98%).
Dado: NaCl è
Na+ + Cl- R:1,98
05.
Os fatores de Van’t Hoff
para duas soluções, uma de KCl e outra de Na2SO4, são,
respectivamente, 1,9 e 2,8. Qual é a razão entre os graus de dissociação
aparentes desses sais nas duas soluções? R:1
Relações
entre os efeitos coligativos verificados numa solução
1-Elevação
da temperatura de ebulição e abaixamento relativo da pressão máxima de
vapor:
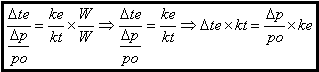 A elevação da temperatura de ebulição de uma solução é diretamente
proporcional ao abaixamento relativo da pressão máxima de vapor da mesma solução.
Isso significa que quanto maior é a elevação da temperatura de ebulição,
maior é o abaixamento relativo da pressão máxima de vapor
A elevação da temperatura de ebulição de uma solução é diretamente
proporcional ao abaixamento relativo da pressão máxima de vapor da mesma solução.
Isso significa que quanto maior é a elevação da temperatura de ebulição,
maior é o abaixamento relativo da pressão máxima de vapor
2-Abaixamento
da temperatura de congelamento e abaixamento relativo da pressão máxima de
vapor:
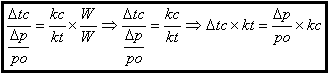 O abaixamento da temperatura de congelamento de uma solução é
diretamente proporcional ao abaixamento relativo da pressão máxima de vapor da
mesma solução.
O abaixamento da temperatura de congelamento de uma solução é
diretamente proporcional ao abaixamento relativo da pressão máxima de vapor da
mesma solução.
3-Elevação
da temperatura de ebulição e abaixamento da temperatura de congelamento:
![]() A elevação da temperatura de ebulição de uma solução é diretamente
proporcional ao abaixamento da temperatura de congelamento da mesma solução.
A elevação da temperatura de ebulição de uma solução é diretamente
proporcional ao abaixamento da temperatura de congelamento da mesma solução.
|
Quando
na mesma solução existem vários solutos, o efeito coligativo total é
igual à soma dos efeitos produzidos separadamente pelos solutos, como se
eles fossem dissolvidos separadamente na mesma quantidade de solvente. |
06.
Uma solução aquosa
apresenta, num volume de 300 ml, 4g de NaOH e 1,17g de NaCl. Admitindo os
solutos 100% dissociados, calcule a pressão osmótica dessa solução a 27OC.
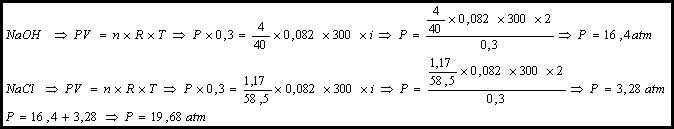
07.
Determine a temperatura de
ebulição, sob pressão normal, de uma solução que contém 2,00g de NaOH (a=100%)
e 1,42g de Na2SO4 (a=98%)
dissolvidos em 800g de água.
Dado:
Ke=0,52OC/molal. R=100,08ºC
08.
Uma solução contendo 3,20g
de K3Fe(CN)6 em 90g de água apresenta um efeito tonoscópico
de 0,005. Determine o grau de dissociação do sal nessa solução.
Dado: K3Fe(CN)6 è
3K+ + Fe(CN)6-3
R: 50%
09.
Determine o abaixamento da
temperatura de congelação de uma solução 0,05 molal de um sal de estrutura CA,
que se encontra 100% dissociado. Dado: Kc=1,86OC/molal R=0,186OC
10.
Qual a temperatura de
congelamento sob pressão normal, de uma solução que apresenta 9,0g de glicose
(M=180) e 6,84g de sacarose (M=342) dissolvidos em 1 kg de água?
Dado: Kc=1,86OC/molal R=-0,13OC
11.
Determinar a mínima
temperatura possível de início de congelamento de uma solução aquosa
contendo 18,0g de glicose (M=180) e 9,50g de MgCl2 (cloreto de magnésio)
(M=95), totalmente dissociado, em 500g de água. Dado: Kc=1,86OC
R=-1,488OC
12.
Uma solução contém 0,01 mol
de sacarose (M=342) e 0,02 mol de sulfato de sódio – Na2SO4
dissolvidos em 372g de água. Sabendo que essa solução congela a –0,34OC,
descubra o grau de dissociação do sulfato de sódio nessa solução.
Dado: Kc=1,86OC/molal. R=95%
13.
Se uma solução aquosa de um
soluto não-dissociável congela a -1,30OC,
qual será a sua temperatura de ebulição?
Dados: Kc=1,86O C/molal e Ke=0,.52O C/molal.
R:100,36
14.
Foi preparada uma solução
pela adição de 1,0 grama de hemoglobina em
água suficiente para produzir 0,10 litro de solução. Sabendo que a
pressão osmótica dessa solução é 2,75mmHg, a 20O C, calcule a
massa molar da hemoglobina. R: 6,7x104
15.
Uma solução aquosa de
sulfato de sódio (Na2SO4) com 90% de dissociação,
apresenta pressão osmótica igual a 12 atm e temperatura de 27O C.
Qual a molaridade da solução?
Dado: Na2SO4 è
2Na+ + 1SO4-2
R: 0,174
16.
Isolou uma proteína de uma
amostra de soro sangüíneo. Uma dispersão coloidal de 685mg da referida proteína,
em água suficiente para formar 10,0 ml de solução, tem uma pressão osmótica de 0,28 atm a 7O C.
Considerando a proteína como sendo um composto covalente típico, qual a sua
massa molecular? R:5,6x103
17.
Duas soluções, I e II, tem
respectivamente a seguinte composição: 17,8g de antraceno (M=178) em 100ml
de benzeno(M=78) e 6,4g de naftaleno (M=128) em 100 ml de benzeno. Determine a relação entre a pressão de vapor pI e pII
dessas soluções, à mesma temperatura. R: pI=0,5pII
18.
A pressão de vapor de uma
solução aquosa não-eletrolítica, contendo 15g de um soluto em 135g de água,
é 750mmHg, a 100O C. Calcule a massa molar do soluto, considerando
que a pressão de vapor da água a 100O C é 760mmHg. R: 152
19.
Uma massa igual a 64,0g de uma
substância Y, dissolvida em 520g de benzeno - C6H6 dá
origem a uma solução cuja pressão de vapor é igual a 79,2 mmHg numa dada
temperatura. Calcule a massa molar de X, sabendo que a pressão de vapor do
benzeno é igual a 88,0 mmHg na mesma temperatura. R: 96
20.
Calcule a pressão de vapor a
80O C de uma solução contendo 11,7g de cloreto de sódio em 360g de
água. Admita um grau de dissociação igual a 100% para o NaCl
e considere a pressão máxima de vapor da água a 80O C igual a
355,1 mmHg.
Dado: NaCl è
1Na+1 + 1Cl-1 R: 348,07mmHg.
21.
São dissolvidos 86,84g de
sacarose (C12H22O11) em água. Qual o número
de partículas dispersas na solução formada? R: 1,204x1022
22.
Uma solução é preparada
dissolvendo-se 102,6g de sacarose (M=342) em água. Calcule o número de partículas
dispersas nessa solução. R: 1,8x1023
23.
Qual a concentração molar
que uma solução aquosa de glicose (M=180) deve ter, em relação à água,
para apresentar a mesma pressão osmótica que
uma solução 0,15M de NaCl (a=100%)?
R: 0,3M
24.
Quantas partículas se
encontram dispersas numa solução que contém 90g de glicose (C6H12O6)
dissolvidas em água? R: 3,01x1023
25.
Calcule o número de partículas
dispersas na solução que contém 6g de uréia (CON2H4)
dissolvidas em água. R: 6,02x1022
26.
São dadas duas soluções
aquosas a 50O C, feitas respectivamente com 62,4g de BaCl2
com a=80%
e 56,2g de Na3Fe(CN)6 com a=50%,
ambas com 540g de água. Qual dessas soluções apresentará maior pressão de
vapor? Qual delas terá maior ponto de ebulição ao nível do mar, considerando
que a pressão de vapor da água a 50O C é 92,51 mmHg. R: O Na3Fe(CN)6
tem maior pressão de vapor. O BaCl2 tem maior
ponto de ebulição.
27.
Sob pressão de 760mmHg, uma
dada solução aquosa molecular, contendo 9g de uma substância X dissolvida em
400g de água, entra em ebulição a 100,26O C. Qual a massa molar da
substância X?
Dado: Ke=0,52O C/molal. R:45
28.
Uma solução de 0,564g de
naftaleno - C10H8 em 48,2g de éter etílico ferve, à
pressão atmosférica, numa temperatura 0,196O C acima da temperatura
de ebulição do éter etílico puro, sob mesma pressão. Qual a constante
ebulioscópica molal do éter etílico? R: 2,144O C.
29.
Considerando que o a
do nitrato de prata - AgNO3 é 60%, determine o fator de Van't Hoff.
R:1,6
30.
Em 40g de um certo solvente,
cuja constante ebuliométrica é igual a 5O C/molal, foram
dissolvidos 2,67g de um composto molecular, provocando um aumento de 1,25O
C na temperatura de ebulição do solvente. Calcule a massa molecular do soluto
e a molalidade da solução. R: 267 e 0,25 molal.
31.
O a
do sulfato de alumínio - Al2(SO4)3
em uma solução aquosa 0,75 molal é de 65%. Qual a temperatura de ebulição
desta solução eletrolítica sob pressão de 760mmHg?
Dado: Ke=0,52O C/molal R:101,4O
C
32.
Dissolvem-se 18,9g de HNO3
em água. Descobrir o número de partículas dispersas nessa solução, sabendo
que o grau de ionização do ácido nítrico é de 92%. R: 3,46x1023
33.
Considere uma solução que
contém 32,8g de ácido sulfuroso - H2SO3 em água.
Sabendo que o grau de ionização do referido ácido é de 30%, calcule o número
de partículas dispersas nessa solução. R: 3,9x1023.
34.
Sabendo que o grau de ionização
do NaOH é de 91%, determine o número de partículas dispersas numa solução
que contém 8g de NaOH dissolvidos em água. R:2,3x1023
35.
Faz-se a determinação prática
da fórmula molecular do enxofre utilizando-se 20 g de naftaleno. C8H10,
cujo ponto de fusão é 80ºC. Com a adição de 4 g de enxofre
verifica-se uma variação de 5,40ºC na temperatura de solidificação do
naftaleno, Conhecendo kc = 6,90O C/molal, calcule a fórmula
molecular do enxofre. R:S8
36.
Calcule o grau de ionização
do sulfato de alumínio - Al2(SO4)3 , sabendo
que uma solução preparada pela dissolução
de 17,52g desse sal em água apresenta 9,632x1022. R: 53%
37.
Duas soluções aquosas, uma
de glicose e outra de sacarose, contém a mesma massa, em gramas, de soluto por
litro de solução, Sabendo que a glicose possui massa molecular 180 e a
sacarose, 342, compare os valores dos pontos de solidificação dessas duas soluções
com o da água pura. Qual das duas soluções apresentará o menor ponto de
solidificação? R: glicose
38.
No preparo de uma solução são
dissolvidos 6g de uréia (CON2H4) em 300g de água, a 20OC.
Calcular a pressão de vapor da água nessa solução, sabendo que a pressão de
vapor da água pura, a 20OC, é de 23,5 mmHg. R:23,359mmHg
39.
Considerando uma solução
aquosa 0,05 molal de um soluto não-eletrolítico e não-volátil, calcule o
efeito tonoscópico e o ebulioscópico, sendo que o Ke é 0,52O C/molal.
R:0,0009; 0,026
40.
Uma solução foi preparada
dissolvendo-se 7,2g de glicose em 360g de água. Calcule a pressão de vapor
dessa solução, a 20OC, sabendo que nessa temperatura a pressão de
vapor da água é de 19,8mmHg.
R: 19,76mmHg
41.
São dissolvidos x gramas de
um soluto não-eletrolítico e não-volátil em 200g de água. Sabendo que o
efeito tonoscópico provocado é de 0,05 e que a massa molecular desse soluto é
54, determine o valor de x.
R:30g
42.
Duas soluções aquosas de KOH
e NH4OH, de mesma molalidade, são submetidas a um esfriamento. Em
qual das soluções a temperatura de início de congelamento da água é mais
baixa? Por quê? R: KOH ( base
forte (>a))
43.
Qual o grau de ionização de
uma solução aquosa de NaCl cuja concentração é de 80g/1000g (80g de soluto
por 1000g de solvente) e que ferve a 101,35OC?
Dados: Ke=0,52OC/molal R:89.8%
44.
Uma solução de glicose se
congela a –0,56OC. Qual é a temperatura de congelação de uma
solução, de mesma molalidade, de cloreto de cálcio – CaCl2,
suposto totalmente dissociado? R: -1,68OC
45.
Uma solução de 16g de CaBr2
em 800g de água eleva de 0,13OC o ponto de ebulição dessa solução.
Qual o grau de dissociação do brometo de cálcio?
Dado: Ke=0,52OC/molal R=75%
46.
Qual será o abaixamento máximo
da temperatura de congelação de uma solução aquosa 0,03 molal de Cr2(SO4)3,
supondo total dissociação?
Dado: Kc=1,86OC/molal R:
0,279O C
47.
Verifique se existe isotonia
entre uma solução aquosa de NaCl 0,1M, à temperatura de 27OC, e
uma solução aquosa de sacarose 0,2M, à mesma temperatura.
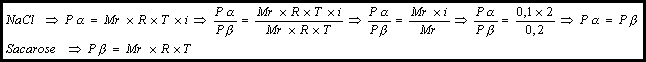
Cancelamos
Ta
e Tb
pois as duas soluções estão à mesma temperatura. Quantos aos fatores de Van’t
Hoff: na primeira solução (a),
como não foi dado o valor de a,
podemos supor o NaCl totalmente dissociado (a=100%)
e a segunda solução – solução molecular (i=1). Isso prova que as duas soluções
são isotônicas.
48.
Uma solução aquosa 0,28M de
glicose é isotônica a uma solução aquosa 0,10M de um cloreto de metal
alcalino-terroso, na mesma temperatura. Calcular o grau de dissociação
aparente do sal. R=0,9 ou 90%
49.
Uma solução aquosa de
cloreto de sódio, na qual se admite o sal totalmente dissociado, ferve à
temperatura de 101,3OC ao nível do mar. Qual o ponto de congelamento
da solução?
Dados: Ke=0,52OC/mol Kc=1,86OC/molal
R=-4,65OC
50.
Em uma solução aquosa, o
grau de ionização do H2SO4 é 85%. Calcule o fator de
Van’t Hoff. R=2,7
51.
Calcule a pressão de vapor a
30O C de uma solução de cloreto de sódio, contendo 10g de NaCl e
250,0g de água. Admita o cloreto de sódio completamente dissociado (pressão máxima
de vapor de água a 30O C = 31,8 mmHg.) R=31,02 mmHg.
52.
Calcular a pressão osmótica,
a 27O C, de uma solução que contém, dissolvidos em 100ml, 0,9g de
glicose (M=180) e 3,42g de sacarose (M=342). R: 3,69 atm.
53.
A temperatura de ebulição de
uma solução que contém 20g de um soluto não-eletrolítico e não-volátil
dissolvidos em 520g de água é de 100,25O C. Calcule a massa
molecular dessa solução, considerando que o Ke seja 0,52OC/molal.
R: 80
54. Dadas as soluções aquosas:
| I) | Glicose 0,5M |
| II) | Uréia
1,0M |
| III) | NaCl 0,5M (a=100%) |
| IV) | CaCl2 0,5M (a=100%) |
a)Qual
delas entrará em ebulição sob uma temperatura maior?
b)coloque-as
em ordem crescente, de acordo com suas temperaturas de congelação.
c)Em
qual delas a pressão osmótica será maior?
|
Para resolver o exercício, calcule o produto Mr.i. A solução
com maior valor de Mr.i terá ponto de ebulição maior, ponto de
congelação menor e maior pressão osmótica. Veja só: |
|||
|
Solução |
Mr |
i |
Mr.i |
|
Glicose |
0,5M |
1 |
0,5 |
|
Uréia |
1,0M |
1 |
1 |
|
NaCl |
0,5M
(a=100%) |
2 |
1 |
|
CaCl2 |
0,5M
(a=100%) |
3 |
1,5 |
a)
a solução IV terá efeitos coligativos mais intensos. Por exemplo,
maior ponto de ebulição;
b)
Quanto maior o produto Mr.i, mais intenso será o efeito crioscópico,
ou seja, menor o ponto de congelação da solução. Portanto, a ordem crescente
das temperaturas de congelação é: IV<III=II<I;
c)
Quanto maior o produto Mr.i, maior será a pressão osmótica.
Portanto, a solução IV terá a maior pressão osmótica.
***Pode-se
concluir que soluções com o mesmo produto Mr.i
possuirão efeitos coligativos de mesma intensidade. Assim, as soluções
II e III tem a mesma pressão de vapor, fervem e congelam na mesma temperatura e
possuem a mesma pressão osmótica (soluções isotônicas).
55.
Em que temperatura ferve uma
solução que contém 1,28g de naftaleno - C10H8
dissolvidos em 100g de benzeno, dado que o benzeno puro ferve a 80OC
e que sua constante ebulioscópica
é de 2,6O C/molal.R:80,26OC
56.
São dissolvidos 20g de uréia
em 400g de água. Sabendo que a constante crioscópica da água é de 1,86O
C/molal, calcular a temperatura de congelamento dessa solução. R: -1,55O
C.
57.
Calcule a temperatura de
congelamento de uma solução que contém 10,26g de sacarose dissolvidos em 500g
de água. R:-0,11O C
58.
Determine a massa de glicose
que deve ser dissolvida em 1860g de água, de modo que a temperatura de
congelamento da solução formada seja de -1OC. Dado: Kc= 1,86O
C/molal. R:180g
59.
São dissolvidos 64g de
naftaleno - C10H8 em 2000g de benzeno. A solução formada
congela-se a 4,5O C. Sabendo que a constante crioscópica do benzeno
é de 5,12O C/molal, calcule a temperatura de congelamento do benzeno
puro. R:5,78O C
60.
São dissolvidos 30g de uréia
em x gramas de água e a solução formada congela-se a -1,5O C.
Descubra o valor de x.
Dado: Kc=1,86. R:620g
61.
Determinar a pressão osmótica,
a 27O C, de uma solução aquosa que, num volume de 2 litros, contém
12g de uréia. R: 2,46 atm.
62.
Uma solução que contém 90g
de glicose num volume de 4,1 litros, a 27O C, é isotônica a uma
solução que contém 12g de uréia também a 27O C. calcular o
volume da solução de uréia. R: 1,64 L.
63.
Calcule a pressão osmótica,
a 27O C, de uma solução que contém 3,42g de sacarose dissolvidos
numa quantidade suficiente de água para 0,6L de solução. R: 0,41
64.
Nos países que costumam ter
um inverno rigoroso, adicionam-se anticongelantes à água do radiador dos automóveis
para impedir que a expansão de volume que acompanha o congelamento da água
rompa os alvéolos do radiador. Do ponto de vista crioscópico, seriam ótimos
anticongelantes sais como MgCl2 , ou CaCl2,, que em soluções
aquosas a 30% em massa congelam em torno de -50ºC. Essas soluções no entanto
são inconvenientes, porque corroem o motor. Alternativamente, empregam-se como
solutos etanol, glicerina ou etilenoglicol, e se obtêm soluções que congelam
entre-10 e-25ºC. Calcule a massa de glicerina, C3H8O3
, que deve ser adicionada por quilo de água para que a solução só comece a
solidificar a -10ºC.
Dado: kc = 1,86OC/molal. R@
494,6 g
65.
A respeito do exercício
anterior, calcule a massa de CaCl2, com a
= 100% que seria necessário adicionar, por
quilo de água, para que a solução comece a se solidificar a -20ºC.
R:398 g
66.
Determine a massa de uréia
que deve ser dissolvida em água para obtermos 8L de solução que, a 27O
C, apresente pressão osmótica de 1,23 atm.
R:24g
67.
São dissolvidos 36g de
glicose em água. Calcule o volume da solução formada, sabendo que, a 47O
C, sua pressão osmótica é de 1,64 atm.
R:32L
68.
O efeito crioscópico é
aplicado na produção de misturas refrigerantes, Na indústria de sorvetes, por
exemplo, emprega-se salmoura, uma solução saturada de NaCl, para manter a água
líquida abaixo de OºC. Calcule a massa de NaCl com a
= 100% que deve ser adicionada por quilograma de H,O para que a mesma só comece
a solidificar a -12ºC.
Dado: kc = 1,86ºC/molal. R@
188,7
69.
São dissolvidos 18g de
glicose numa quantidade suficiente de água para 8,2L de solução. Essa solução,
a 27O C, é isotônica a uma solução de uréia cujo volume é de
6L. Calcule a massa de uréia.
R:4,4g
70.
Prepara-se , em água, uma
solução que apresenta 12%, em massa , de uréia. Calcule a temperatura de
congelamento dessa solução, sabendo que o Kc é 1,86O C/molal.
R:-4,23
71.
Considere uma solução aquosa
0,35 molal de um soluto não-eletrolítico e não-volátil. Determine o efeito
crioscópico, sabendo que o Kc da água é 1,86O C/molal.
R:0,651
72.
Calcule a pressão osmótica,
a 27O C, de uma solução 0,15M de glicose - C6H12O6.
R: 3,69
73.
A pressão osmótica de uma
solução aquosa de uréia, a 27O C, é de 6,15 atm. Determine a
concentração molar dessa solução.
R:0,25
74.
Uma solução não-eletrolítica
apresenta, a 28O C, uma pressão osmótica de 0,82 atm. Calcule o
volume dessa solução que contém 1020 partículas de soluto.
R:0,005L.
75.
A pressão de vapor do éter
dietílico - C4H10O, a 20O C, é igual a
440mmHg, Dissolvem-se 23,35g de anilina - C6H7N, em 129,5
de éter dietílico. Calcule a pressão de vapor desta solução, a 20O
C.
R: 385mmHg,
76.
Uma injeção endovenosa deve
ser isotônica em relação ao sangue para não lisar os glóbulos vermelhos. Se
o sangue possui pressão osmótica igual a 7,65 atm a 37O C, calcule
a massa de glicose (M=180) que deve ser utilizada para preparar 10ml de uma injeção
endovenosa.
R: 0,54g
77.
Utilizando os dados do exercício
anterior, calcule a massa de cloreto de sódio (NaCl) com a=100%
necessária para preparar um litro de soro fisiológico injetável (solução
aquosa de NaCl).
R: 8,8g
78.
Com 20,86g de As2S3
prepara-se uma um litro de solução coloidal dessa substância. O sistema
obtido apresenta pressão osmótica igual a 7,6mmHg a 27O C. Qual o número
de moléculas de As2S3 que constituem a micela do colóide
obtido?
R:208
79.
Soluções isotônicas são
aquelas que possuem a mesma pressão osmótica. O sangue humano tem pressão osmótica
igual a 7,8 atm, a 37O C. Qual deverá ser a concentração molar de
um soro glicosado para ser isotônico do sangue.
R=0,3M
80.
Observe as substâncias e suas
concentrações: NaCl (0,3M); glicose (0,3M); uréia (0,9M); sacarose (0,01M) e
glicose (0,033M). À mesma temperatura, qual a solução acima que apresenta a
mesma pressão osmótica que uma solução de BaCl2, cujo grau de dissociação
é 100%.
R: glicose 0,3M
81.
Calcule a pressão osmótica
de 12,0 g de um polímero de massa molar 12000g que, adicionados à água,
originaram 100ml de solução a 27OC.
R: 0,25
82.
Um químico precisa descobrir
se uma amostra de açúcar puro consiste em glicose (M=180) ou sacarose (M=342).
Para tanto, dissolveu 8,55g da amostra em 50g de água e verificou que a solução
iniciava a ebulição a 100,26O C. Qual era o açúcar da amostra?
Dado: Ke=0,52OC/molal R=Sacarose.
83.
O enxofre coloidal apresenta
micelas formadas pela reunião de um número elevado de moléculas S8.
Preparam-se 100ml de um sistema que contém 10,4065g de enxofre disperso em água.
A pressão osmótica a 27O C de um tal sistema coloidal é igual a
0,0100 atm. Pede-se o número de unidades S8 que formam a micela do
colóide.
R:1000
84.
Qual deverá ser a concentração
molar de uma solução de cloreto de cálcio – CaCl2 (a=100%)
tal que seja isotônica de uma solução 0,9M de NaCl (a=100%)
na mesma temperatura?
|
CaCl2è a=100%; Mr=?;
i=3 è P=Mr.R.T.i è P=Mr.R.T.3 |
|
|
NaClè a=100%; Mr=0,9M;
i=2 èP=Mr.R.T.iè P=0,9.R.T.2 |
85.
No que se refere a efeitos
coligativos, a água do mar se comporta com uma solução 0,6M de NaCl, com
fator de Van’t Hoff igual a 2. Determine a pressão osmótica do mar, a 25O
C.
R=29 atm
86.
O soro fisiológico é uma
solução aquosa de NaCl com 0,92% em massa de sal e densidade 1,0g/ml. Admita
que esse soro seja isotônico de nossas lágrimas a 37OC. Qual a
pressão osmótica da solução que
constitui uma lágrima humana?
R:8,0 atm
87.
Uma solução aquosa 0,1M de
nitrato de bário – Ba(NO3)2 (a=100%)
terá efeitos coligativos iguais aos de uma solução aquosa de uréia com qual
concentração molar?
R: 0,3M
88.
A 25OC, uma solução
1,2M de KCl (a=100%)
terá efeitos coligativos iguais aos de uma solução de CaCl2 (a=100%)
com que concentração?
R:0,8M