

São
chamadas de propriedades coligativas das soluções aquelas que se relacionam
diretamente com o número de partículas de soluto que se encontram dispersas
(dissolvidas) em um determinado solvente.
Durante
o estudo de cada uma das propriedades coligativas, será necessário sempre
comparar o comportamento da solução com o respectivo solvente puro.
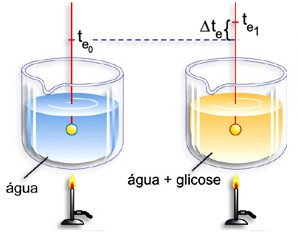
Para
ilustrar um exemplo de tal comparação, verifique que ao se aquecer água pura,
ao nível do mar, a temperatura de ebulição da água (solvente puro) é igual
a 100O C. No entanto, quando se aquece uma solução aquosa de
cloreto de sódio, percebe-se que o ponto de ebulição da água sofre um
aumento.
A
elevação do ponto de ebulição da água na solução aquosa foi ocasionada
pela presença do soluto. Com isso, percebe-se que a adição de um soluto
sempre irá produzir efeitos em algumas propriedades físicas de um solvente,
que são: aumento do ponto de ebulição, diminuição do ponto de congelamento,
diminuição da pressão de vapor, aumento da pressão osmótica.
Tais
efeitos são conhecidos como efeitos coligativos, que dependem exclusivamente da
concentração (quantidade) de partículas que se encontram dispersas em um
solvente. Os efeitos coligativos definem as quatro propriedades coligativas
importantes que serão apresentadas em nosso estudo. São elas: Tonoscopia,
ebulioscopia, crioscopia e osmometria.
Antes
de iniciar o estudo de cada uma dessas propriedades, é necessário aprender a
calcular o número de partículas de soluto que estão dissolvidas em solução.
Cálculo
em soluções moleculares que não sofrem ionização:
o número de partículas (moléculas) dissolvidas é igual ao número de partículas
que se encontram em solução.
1.
Calcular o número de partículas de sacarose em 1 litro de solução de
concentração igual a 5 mol/L.
Resolução:
Em cada litro de solução há 5 mols de sacarose dissolvidos. Considerando que
1 mol de sacarose apresenta 6,02x1023 partículas (moléculas) e que
temos 5 mols, basta multiplicar 5 x 6,02x1023 o
que dará 30,1x1023, ou seja, 3,01x1024 partículas
dissolvidas em um litro de solução.
2.
Determinar o número de partículas de glicose (C6H12O6)
existente em 54g desse soluto.R: 1,806x1023
3.
Calcular o número de partículas de uréia (CON2H4)
existente em 6g desse soluto.R: 6,02x1022
4.
Calcular o número de partículas de sacarose (C12H22O11)
em 250mL de solução de concentração igual a 5 mol/L. R: 7,525x1023
partículas
5.
São dissolvidos 86,84g de sacarose (C12H22O11)
em água. Qual o número de partículas dispersas na solução formada? R:
1,528x1023
Cálculo
em soluções iônicas ou que sofrem ionização:
para a realização dos cálculos com solutos iônicos ou que sofrem ionização,
é necessário levar em consideração, em várias situações, o grau de ionização
ou dissociação (a)
da substância que se encontra dissolvida.
6. Calcular o número de partículas dissolvidas em um litro de uma solução 1M de sulfato de alumínio – Al2(SO4)3 , cujo grau de dissociação é 60%.
Resolução:
1Al2(SO4)3
-->
2 Al+3 + 3 SO4-2
1mol 5
mols de íons
Em
cada litro de solução há 1 mol de sulfato de alumínio dissolvido.
Considerando que 1 mol de sulfato de alumínio apresenta 6,02x1023
partículas (íons) e que temos apenas 60% de um mol dissociado, ou seja, 0,6
mol foi dissociado e 0,4 mol não-dissociado.
O
primeiro passo será calcular o número de partículas dissociadas:
1
mol de Al2(SO4)3 -------------------5 x 6,02x1023
0,6
mol ---------------------------------- X
X=1,806x1024
partículas dissociadas
O
segundo passo será calcular o número de partículas não-dissociadas:
1
mol de Al2(SO4)3 -------------------1 x 6,02x1023
0,4
mol ---------------------------------- Y
Y=2,408x1023
partículas não-dissociadas
O
terceiro passo será calcular o número total de partículas, que será a soma
de X e Y:
NT
= X + Y -->
NT = 1,806x1024 + 2,408x1023 -->
NT = 2,0468x1024 partículas.
7.
Calcular o número total de partículas existentes em um litro de uma
solução1M de ácido nítrico (HNO3), considerando que o grau de
ionização é 92%.R: 1,158x1024
Considerando
as soluções contendo todos os solutos a seguir, calcule o número de partículas
dissolvidas para as quantidades indicadas em cada item:
8.
315 g de ácido nítrico (HNO3) com a
= 92% R: 5,76x1024
9.
588 g de ácido ortofosfórico (H3PO4) com a=40%
R: 7,9464x1024
FATOR
DE VAN’T HOFF: Para
facilitar o cálculo do número de partículas, será usado um fator i,
conhecido como fator de Van’t Hoff. Logo, em uma solução iônica tem-se que
o número total de partículas será: “o número de partículas livres em
solução é igual ao número de partículas dissolvidas multiplicado pelo fator
de Van’t Hoff”.
Segundo
o cientista holandês, i=1+a(q-1)
em que q é igual ao número total de íons que se encontram livres em
solução; o a
é o grau de dissociação ou ionização. Não podemos esquecer que os ácidos,
mesmo sendo substâncias moleculares, sempre formarão soluções iônicas,
devido ao efeito da ionização.
Calcule
o fator de Van’t Hoff para as seguintes soluções:
10.
sulfato de alumínio – Al2(SO4)3 –
a=75%
R:4
11.
nitrato de prata – AgNO3 –
a=60%
R:1,6
12.
ácido sulfúrico – H2SO4 –
a=60%
R:2,2
13.
ácido ortofosfórico– H3PO4 –
a=27%
R:1,81
14.
hidróxido de cálcio – Ca(OH)2 –
a=90%
R:2,8
15.
cloreto de sódio – NaCl
– a=98%
R:1,98
16.
Numa solução aquosa, o grau de ionização do ácido sulfúrico (H2SO4)
é 85%. Calcule o fator de Van’t Hoff. R=2,70
17. Dissolvem-se 18,9g de ácido nítrico (HNO3) em água. Descobrir o número de partículas dispersas nessa solução, sabendo que o grau de ionização do referido ácido é de 92%
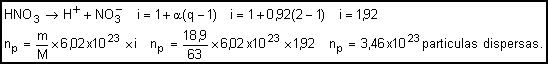
18.
Considere uma solução que contém 32,8g de ácido sulfuroso (H2SO3)
em água. Sabendo que o grau de ionização do referido ácido é de 30%,
calcule o número de partículas dispersas nessa solução. R=3,8528x1023
19.
Sabendo que o grau de ionização do hidróxido de sódio – NaOH – é
de 91%, determine o número de partículas dispersas numa solução que contém
8g de NaOH dissolvidos em água. R=2,2996x1023
20.
Descubra o número de partículas dispersas numa solução preparada pela
dissolução de 2,565g de hidróxido de bário – Ba(OH)2 – em água,
sabendo que nessa solução o hidróxido encontra-se 75% dissociado. R=2,2575x1022
Pressão Máxima de Vapor (PMV)
Consideremos um cilindro fechado contendo um líquido, com um espaço disponível acima do nível do líquido, e um manômetro. O nível de mercúrio nos dois ramos está na mesma altura, conforme a figura:
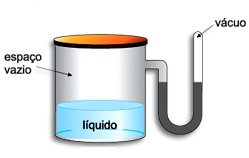
Inicialmente ocorre apenas o movimento de moléculas do líquido para o espaço vazio. Forma-se uma fase gasosa. O vapor do líquido exerce uma pressão que é medida no manômetro. Verifica-se que o nível de mercúrio no ramo da direita vai subindo até que estaciona, conforme a figura:
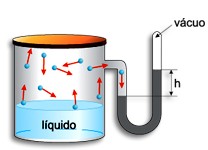
O desnível h entre os dois níveis de mercúrio mede a pressão exercida pelo vapor do líquido. Dessa forma, podemos concluir que a pressão exercida pelo vapor em equilíbrio com o líquido chama-se pressão máxima de vapor (PMV), já que antes de atingir o equilíbrio, a velocidade de vaporização é maior que a velocidade de condensação. A quantidade de vapor vai aumentando e, portanto, a pressão de vapor também aumenta. Quando atinge o equilíbrio, a concentração de moléculas na fase de vapor fica constante e a pressão não aumenta mais, isto é, atinge o seu valor máximo.
A velocidade de vaporização é constante, porque a superfície do líquido e a temperatura não mudam.
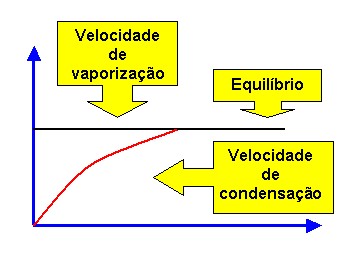
No equilíbrio, a velocidade de condensação iguala a velocidade de vaporização, isto é, o número de moléculas que deixam o líquido fica igual ao número de moléculas que retornam para o líquido. A pressão máxima de vapor ou pressão de vapor do equilíbrio costuma ser indicada apenas por pressão de vapor. O vapor em equilíbrio com o seu líquido é chamado vapor saturante.
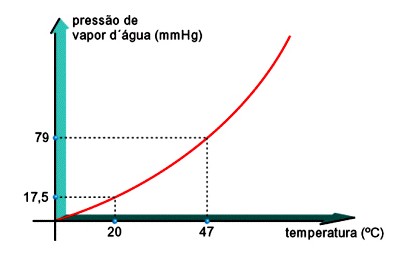
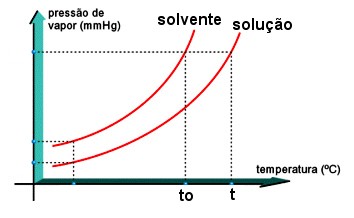
A pressão de vapor depende da natureza do líquido. Se as moléculas estão presas fortemente ao líquido, a vaporização é difícil e a pressão de vapor é pequena. Mas se, ao contrário, as moléculas estão presas fracamente no líquido, a vaporização ocorre facilmente e a pressão de vapor é grande. Por exemplo, veja que a 20ºC, a PMV da água é 17,5 mmHg, enquanto que a PMV do álcool etílico é 44 mmHg. Dessa forma, podemos concluir que o álcool é mais volátil que a água.
Para um mesmo líquido, a PMV aumenta à medida que aumenta a temperatura. Por exemplo, a 27ºC, a PMV da água é 26 mmHg, e a 47ºC, é 79 mmHg.

Costuma-se representar a influência da temperatura na PMV em diagramas:
Experimentalmente, a ebulição é caracterizada pela formação de bolhas no líquido. Essas bolhas vão até a superfície e rebentam. A bolha, se formada no interior do líquido puro, contém somente moléculas no estado gasoso do líquido puro. Essas moléculas exercem, então, uma pressão contra as paredes internas da bolha. Consideremos uma bolha logo abaixo da superfície do líquido.
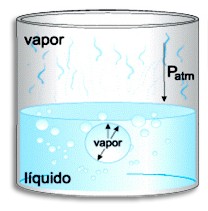
Neste caso, podemos considerar, aproximadamente, que a força que empurra a bolha para o interior do líquido é a que origina a pressão atmosférica. Aquecendo o líquido, a pressão de vapor na bolha aumenta e, a uma certa temperatura, iguala-se à pressão atmosférica, escapando do líquido. Esta é a temperatura de ebulição.
Podemos então definir como Ponto de ebulição a temperatura na qual a pressão de vapor do líquido se iguala à pressão que existe sobre a superfície do líquido.
Quanto maior a PMV nas condições ambientes, mais fácil se torna ferver o líquido, isto é, quanto menor for o ponto de ebulição, mais volátil será o liquido. Assim, a 20ºC, a PMV da água é 17,5 mmHg e o álcool, 44 mmHg. Veja o gráfico:
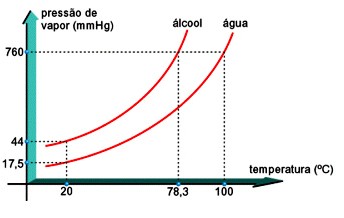
Ao nível do mar (1 atm = 760 mmHg), o álcool ferve a 78,3ºC, e a água, a 100ºC. Observe no gráfico que, aumentando a temperatura, a PMV aumenta. a 78,3ºC, o álcool ferve, pois sua PMV se iguala à pressão atmosférica. A PMV da água fica igual a 760 mmHg, a 100ºC.
Quanto maior a PMV nas condições ambientes, mais fácil se torna ferver o líquido, isto é, quanto menor for o ponto de ebulição, mais volátil será o liquido.

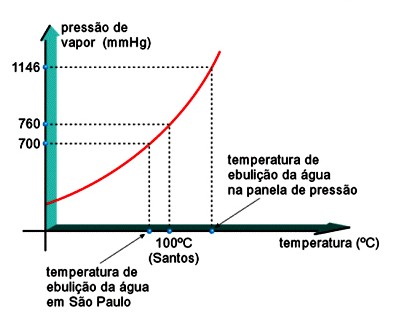
Em Santos, ao nível do mar, onde a pressão atmosférica é 1 atm (760 mmHg), a água entra em ebulição a 100ºC. Em São Paulo, a pressão atmosférica é aproximadamente 700 mmHg e, conseqüentemente, a água ferve a uma temperatura menor que 100ºC.
Em uma panela de pressão, a pressão que existe sobre a superfície do líquido está entre 1146 mmHg e 1500 mmHg, fazendo com que a água ferva a uma temperatura maior que 100ºC.
Tonoscopia ou tonometria: representa o estudo da diminuição da pressão máxima de vapor (PMV) de um solvente quando se adiciona a ele um soluto não-volátil. Em relação à pressão de vapor de um solvente puro, pode-se dizer que sempre ela será maior do que a pressão de vapor de uma solução. Isso decorre do fato de que as partículas do soluto roubarem energia cinética das moléculas do solvente, impedindo que parte destas ganhem o estado de vapor. As partículas dispersas constituem uma barreira que dificulta a movimentação das moléculas do solvente do líquido para a fase gasosa.
A diferença entre a pressão máxima de vapor do solvente puro e a pressão máxima de vapor do solvente em solução denomina-se abaixamento da pressão máxima de vapor. Com isso, é possível estabelecer a seguinte condição para as soluções: Quando maior a quantidade de partículas em uma solução, menor será a sua pressão de vapor.
O abaixamento da PMV (DP) depende da temperatura. Ao quociente entre o abaixamento da pressão máxima de vapor (DP) e a pressão máxima de vapor do solvente puro (po) damos o nome de abaixamento relativo da pressão máxima de vapor. Este independe da temperatura, porque a variação desta provoca uma variação de DP e p, da mesma magnitude, não alterando o quociente, desde que o soluto seja não-volátil.
O
abaixamento da pressão de vapor provocado pela adição de um soluto não-volátil
pode ser calculado por meio da seguinte expressão, conhecida como Lei de Raoult.
![]()
21.
Em uma solução foram dissolvidos 150g de sacarose (M1=342
g/mol) em 750g de água. Sabe-se que a pressão de vapor da água pura no local
onde se encontra a solução é igual a 190 mmHg. Calcular o abaixamento
relativo da pressão máxima de vapor, o abaixamento absoluto da pressão de
vapor e a pressão máxima de vapor da solução. R: 0,01; 1,9 mmHg e 188,1 mmHg
22.
No preparo de uma solução são dissolvidos 15g de uréia (CON2H4)
em 450g de água, numa determinada temperatura. Calcule a pressão de vapor da
água na solução, nessa temperatura, considerando que a pressão de vapor da
água pura seja igual a 23,54 mmHg. R=23,3 mmHg
23.
Em três recipientes A, B e C, há volumes iguais de soluções de
glicose (M1=180 g/mol), uréia (M1=60 g/mol) e sacarose (M1=342
g/mol), respectivamente. As massas de cada soluto, que foram dissolvidas,
correspondem a 36g de glicose, 12g de uréia e 68,4g de sacarose. Baseado nessas
informações, em qual das soluções a pressão de vapor é maior? Justifique a
resposta.R: as três soluções possuem a mesma pressão de vapor.
24.
Calcule a pressão de vapor a 80O C de uma solução contendo
11,7g de cloreto de sódio em 360g de água. Admita um grau de dissociação
igual a 100% para o NaCl e considere a pressão máxima de vapor da água a
80OC igual a 355,1 mmHg. R: 348,07mmHg.
25. Calcule a pressão de vapor a 30O C de uma solução de cloreto de sódio, contendo 10g de NaCl e 250,0g de água. Admita o cloreto de sódio completamente dissociado (pressão máxima de vapor de água a 30O C = 31,8 mmHg.) R=31,02 mmHg
26.
A pressão de vapor do éter dietílico - C4H10O, a
20O C, é igual a 440mmHg, Dissolvem-se 23,35g de anilina - C6H7N,
em 129,5 de éter dietílico. Calcule a pressão de vapor desta solução, a 20OC.
R: 376,9mmHg,
27.
Uma certa quantidade de sacarose (C12H22O11) é
dissolvida em 720g de água. Calcule a massa de sacarose nessa solução sabendo
que, na temperatura considerada, o abaixamento relativo da pressão de vapor da
água na solução é 0,002. R=27,36g
28.
Determine o abaixamento relativo da pressão de vapor da água numa solução
que contém 20g de glicose (C6H12O6)
dissolvidos em 800g de água, em determinada temperatura. R=0,0025
29.
Uma solução contendo 3,20g de K3Fe(CN)6 em 90g de
água apresenta um efeito tonoscópico de 0,005. Determine o grau de dissociação
do sal nessa solução. Dado: K3Fe(CN)6 -->
3K+ + Fe(CN)6-3
R: 52,3%
Ebuliometria ou ebulioscopia: é o estudo do aumento do ponto de ebulição de um solvente quando se adiciona a ele um soluto não-volátil. Em relação ao ponto de ebulição de uma solução, é possível afirmar que ele sempre será maior que o ponto de ebulição do solvente puro.
A temperatura de ebulição de um líquido é a temperatura na qual a pressão de vapor do líquido é igual à pressão a que este líquido está submetido.
Com a variação da pressão externa, ocorre variação da temperatura de ebulição.
Quando adicionamos soluto não-volátil a um solvente líquido, também ocorre aumento da temperatura de ebulição. O soluto não-volátil atrapalha a evaporação das moléculas, roubando-lhes energia cinética.
Se tomarmos um solvente puro e uma solução, observaremos que a solução ferverá a uma temperatura superior à temperatura de ebulição do solvente. O aumento da temperatura de ebulição, após adicionarmos soluto, denomina-se elevação da temperatura de ebulição.
Assim
pode-se afirmar que: “Quanto maior a quantidade de partículas dispersas
em uma solução, maior será o seu ponto de ebulição.”
![]()
Uma solução tem ponto de ebulição variável, pois, à medida que o solvente vaporiza, a concentração da solução restante aumenta, fazendo com que a temperatura de ebulição aumente.
30.
Calcular a temperatura de ebulição de uma solução que contém 60g de
glicose (C6H12O6) dissolvidos em 500g de água,
sabendo que a temperatura de ebulição da água pura é de 100O C e
a constante ebuliométrica é de 0,52O C/molal. R=100,346O
C
31.
São dissolvidos 5,4g de glicerol em 500g de água. Determine a
temperatura de ebulição dessa solução, sabendo que a constante ebuliométrica
é de 0,52O C/molal e a molécula-grama do glicerol é de 102g.
R=100,055O C
32.
Que massa de uréia (CON2H4) deve ser dissolvida em
200g de água para que a temperatura de ebulição da solução seja igual a
100,26O C? Dado: KE=0,52O C/molal
R=6g
33.
São dissolvidos 6,84g de sacarose (C12H22O11)
em 800g de água. Calcule a temperatura de ebulição de uma solução, sabendo
que a constante ebuliométrica é de 0,52O C/molal. R=100,013O
C
34.
Uma solução de 16g de CaBr2 em 800g de água eleva de 0,13OC
o ponto de ebulição dessa solução. Qual o grau de dissociação do brometo
de cálcio? Dado: Ke=0,52OC/molal
R=75%
35.
A temperatura de ebulição de uma solução que contém 20g de um soluto
não-eletrolítico e não-volátil dissolvidos em 520g de água é de 100,25O
C. Calcule a massa molecular dessa solução, considerando que o Ke seja 0,52OC/molal.
R: 80
36.
Determinar a temperatura de ebulição de uma solução que contém 20g
de sulfato de sódio (Na2SO4), dissolvidos em 400g de água,
sabendo que a constante ebulioscópica da água é de 0,52OC/molal e
que o grau de dissociação do sal é de 25%. R=100,275O C
37.
Qual o grau de ionização de uma solução aquosa de NaCl cuja concentração
é de 80g/1000g (80g de soluto por 1000g de solvente) e que ferve a 101,35OC?
Dados: Ke=0,52OC/molal R:89.8%
38.
Em 40g de um certo solvente, cuja constante ebuliométrica é igual a 5O
C/molal, foram dissolvidos 2,67g de um composto molecular, provocando um aumento
de 1,25O C na temperatura de ebulição do solvente. Calcule a massa
molecular do soluto e a molalidade da solução. R: 267 e 0,25 molal.
39.
O grau de dissociação do sulfato de alumínio - Al2(SO4)3
em uma solução aquosa 0,75 molal é de 65%. Qual a temperatura de ebulição
desta solução eletrolítica sob pressão de 760mmHg? Dado: Ke=0,52O
C/molal R:101,4O C
40.
Calcular a temperatura de ebulição de uma solução que contém 42,6g
de sulfato de sódio (Na2SO4), dissolvidos em 240g de água,
sabendo que a constante ebulioscópica da água é de 0,52OC/molal e
que o grau de dissociação do sal é de 30%. R=101,04O C
41.
Em 40g de um certo solvente, cuja constante ebuliométrica é igual a 5O
C/molal, foram dissolvidos 2,67g de um composto molecular, provocando um aumento
de 1,25O C na temperatura de ebulição do solvente. Calcule a massa
molecular do soluto e a molalidade da solução. R: 267 e 0,25 molal.
Criometria
ou crioscopia: é o
estudo do abaixamento do ponto de congelamento de um solvente quando se adiciona
a ele um soluto não-volátil. Em relação ao ponto de congelamento de uma solução,
é possível afirmar que a solução apresentará sempre ponto de congelamento
menor do que o do solvente puro.
Assim
pode-se afirmar que: “Quanto
maior a quantidade de partículas dispersas em uma solução, meno será o seu
ponto de congelamento.”
![]()
A criometria no cotidiano: Nos recipientes onde ficarão as bebidas para gelar, coloca-se gelo e sal, pois o gelo e o sal formam uma mistura que funde a -22ºC (mistura eutética). Uma parte do gelo derrete, pois a sua temperatura éstá acima de -22ºC. Sendo a fusão um processo endotérmico, a temperatura da mistura gelo e sal é abaixada, e assim as bebidas ficam mais geladas.
A criogenia (geração de frio) é uma tecnologia que abrange a produção e a utilização do frio muito intenso (na faixa de -100ºC) por meio dos chamados gases criogênicos (He, Ne, N2, Ar, O2, Kr, Xe e CO2) que podem ser obtidos a partir da liquefação do ar atmosférico e posterior destilação fracionada. Entretanto, por razões econômicas, o hélio é obtido em jazidas de gas natural e o gás carbônico, da queima do gás natural ou nos processos de fermentação. Os gases mais utilizados são o nitrogênio (PE=-196ºC) e o gás carbônico (PE=-78ºC). O nitrogênio é usado rotineiramente em conservação de tecidos, embriões, esperma, óvulos, etc e o gás carbônico, com o nome de gelo-seco, em carrinhos de sorvete, na conservação de alimentos em acampamentos.
42.
São dissolvidos 20g de uréia (CON2H4) em 400g de
água. Sabendo que a constante crioscópica da água é de 1,86O C/molal,
calcular a temperatura de congelamento dessa solução.R=-1,55OC
43.Calcule
a temperatura de congelamento de uma solução que contém 10,26g de sacarose (C12H22O11)
dissolvidos em 500g de água. Considere o KC igual a 1,86O
C/molal. R= –0,1116O C
44.
Determine a massa de glicose (C6H12O6)
que deve ser dissolvida em 1860g de água, de modo que a temperatura de
congelamento da solução formada seja de –1O C, considerando o KC
igual a 1,86O C/molal. R=180g
45.São
dissolvidos 64g de naftaleno (C10H8) em 2000g de benzeno.
A solução formada congela-se a 4,5O C. Sabendo que a constante
crioscópica do benzeno é de 5,12O C/molal, calcule a temperatura de
congelamento do benzeno puro. R= 5,78O C
46.
São dissolvidos 30g de uréia (CON2H4) em x gramas
de água e a solução formada congela-se a –1,5OC. Descubra o
valor de x. Dado: KC=1,86O C/molal. R=620g
47.
Determine o abaixamento da temperatura de congelação de uma solução
0,05 molal de um sal de estrutura CA, que se encontra 100% dissociado.
Dado: Kc=1,86OC/molal R=0,186OC
48. Uma solução de glicose se congela a –0,56OC. Qual é a temperatura de congelação de uma solução, de mesma molalidade, de cloreto de cálcio – CaCl2, suposto totalmente dissociado? R: -1,68OC
49.
Qual será o abaixamento máximo da temperatura de congelação de uma
solução aquosa 0,03 molal de sulfato de cromo - Cr2(SO4)3,
supondo total dissociação? Dado: Kc=1,86OC/molal
R: 0,279O C
50.
Uma solução aquosa de cloreto de sódio, na qual se admite o sal
totalmente dissociado, ferve à temperatura de 101,3OC ao nível do
mar. Qual o ponto de congelamento da solução? Dados: Ke=0,52OC/mol
Kc=1,86OC/molal R=-4,65OC
51.
O efeito crioscópico é aplicado na produção de misturas
refrigerantes, Na indústria de sorvetes, por exemplo, emprega-se salmoura, uma
solução saturada de NaCl, para manter a água líquida abaixo de OºC. Calcule
a massa de NaCl com grau de dissociação = 100% que deve ser adicionada por
quilograma de H2O para que a mesma só comece a solidificar a -12ºC.Dado:
kc = 1,86ºC/molal. R=188,7
52.
Nos países que costumam ter um inverno rigoroso, adicionam-se
anticongelantes à água do radiador dos automóveis para impedir que a expansão
de volume que acompanha o congelamento da água rompa os alvéolos do radiador.
Do ponto de vista crioscópico, seriam ótimos anticongelantes sais como MgCl2
, ou CaCl2, que em soluções aquosas a 30% em massa congelam em
torno de -50ºC. Essas soluções no entanto são inconvenientes, porque corroem
o motor. Alternativamente, empregam-se como solutos, etanol, glicerina ou
etilenoglicol, e se obtêm soluções que congelam entre-10 e-25ºC. Calcule a
massa de glicerina, C3H8O3 , que deve ser
adicionada por quilo de água para que a solução só comece a solidificar a
-10ºC, Dado: kc = 1,86OC/molal.
R=494,6 g
53.
A respeito do exercício anterior, calcule a massa de CaCl2,
com grau de dissociação 100% que seria necessário adicionar,
por quilo de água, para que a solução comece a se solidificar a -20ºC.
R:398 g
54.Considere
uma solução aquosa 0,35 molal de um soluto não-eletrolítico e não-volátil.
Determine o efeito crioscópico, sabendo que o Kc da água é 1,86O
C/molal. R:0,651
Osmometria
ou osmoscopia: entende-se
por osmose a passagem de um solvente (líquido) por meio de uma membrana
semipermeável, de um meio menos concentrado (diluído) para o meio mais
concentrado.
Para
impedir a passagem do solvente para o meio mais concentrado, é necessário
aplicar uma pressão sobre a solução concentrada, que será chamada de pressão
osmótica. Dessa forma, podemos definir pressão osmótica como “a pressão
que se deve aplicar à solução para não deixar o solvente atravessar a
membrana semipermeável”.
Consideremos uma campânula hermeticamente fechada, contendo um béquer com água pura e outro béque com uma solução aquosa de glicose, conforme o desenho a seguir:
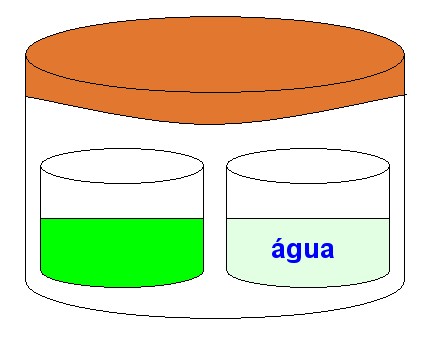
A água pura tem maior pressão de vapor que a solução aquosa de glicose, isto é, a água pura evapora mais facilmente. Como conseqüência há uma transferência de água do béquer da direita para o béquer da esquerda. Passado um tempo, teremos a seguinte condição:
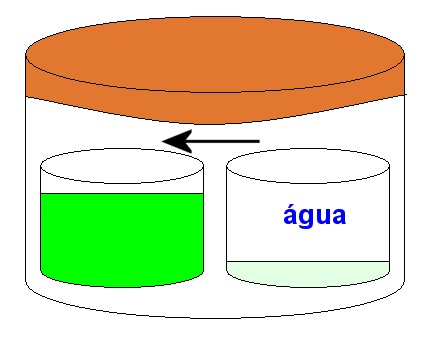
Na osmose ocorre fenômeno semelhante. Admite-se que o solvente atravessa a membrana semipermeável na forma de vapor, ocorrendo uma verdadeira destilação do mesmo. Evapora em um lado e condensa no outro lado, conforme o desenho a seguir:
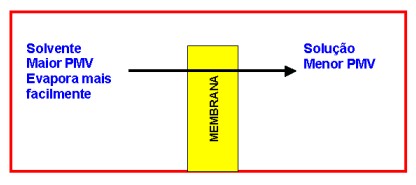
A
aplicação da pressão osmótica só é válida para soluções diluídas, nas
quais a molaridade e, aproximadamente, igual à molalidade.Não podemos esquecer
dos tipos de membranas:
o
Permeáveis:
são aquelas que permitem a passagem tanto do solvente como do soluto;
o
Semipermeáveis:
são aquelas que permitem apenas a passagem do solvente;
o
Impermeáveis:
são aquelas que não permitem a passagem do soluto e solvente.
![]()
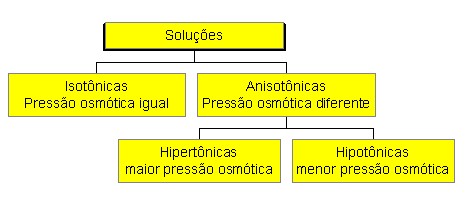
A osmose no cotidiano: Em condições normais, a água entra e sai continuamente das células, difundindo-se em direção à região em que há menor número de moléculas de água, estabelecendo o equilíbrio osmótico. Se uma célula viva, por exemplo, uma hemácia, for colocada em solução salina que apresenta concentração superior à célula, haverá um fluxo de água, através da membrana plasmática, de dentro da célula (menor concentração) para fora da célula (maior concentração), provocando a sua contração. Ao contrário, se o meio for hipotônico, a célula ficará intumescida. Isso faz com que a administração de soro deva ser feita com solução isotônica. Nos vegetais existe, além da membrana plasmática, outra membrana (celulósica) que limita a entrada de água, evitando que as células se rompam.
Osmose reversa: consiste em aplicar uma elevada pressão para fazer com que a água flua de uma solução mais concentrada para uma solução menos concentrada, através de uma membrana semipermeável. Podemos utilizar a osmose reversa para obter a dessalinização das águas dos oceanos, já que a pressão osmótica da água do mar é da ordem de 30 atm. Se aplicarmos uma pressão superior a 30 atm, o fluxo osmótico será revertido e poderemos obter água potável.
55.
A pressão osmótica do sangue na temperatura do corpo, 37O C,
é de 7,62 atm. Considerando todos os solutos do sangue como sendo moleculares,
calcule a molaridade total do sangue. R=0,3M
56.
Eventualmente, a solução 0,3M de glicose é utilizado em injeções
intravenosas, pois tem pressão osmótica próxima à do sangue. Qual a pressão
osmótica, em atm, da referida solução, a 37OC? R=7,626 atm
57.
Sabe-se que 2,8g de um composto orgânico são dissolvidos em benzeno,
fornecendo 500 mL de uma solução molecular que, a 27O C, apresenta
pressão osmótica igual a 2,46 atm. Qual a massa molar do composto orgânico?
R=56
58.Foi
preparada uma solução pela adição de 1,0 grama de hemoglobina em água suficiente para produzir 0,10 litro de solução.
Sabendo que a pressão osmótica dessa solução é 2,75mmHg, a 20O
C, calcule a massa molar da hemoglobina. R: 6,7x104
59.
Determine a massa de uréia que deve ser dissolvida em água para
obtermos 8L de solução que, a 27O C, apresente pressão osmótica
de 1,23 atm. R:24g
60.
São dissolvidos 36g de glicose em água. Calcule o volume da solução
formada, sabendo que, a 47O C, sua pressão osmótica é de 1,64 atm.
R:32L
61.
Uma solução aquosa de sulfato de sódio (Na2SO4)
com 90% de dissociação, apresenta pressão osmótica igual a 12 atm e
temperatura de 27O C. Qual a molaridade da solução? R: 0,174
62.
Isolou uma proteína de uma amostra de soro sangüíneo. Uma dispersão
coloidal de 685mg da referida proteína, em água suficiente para formar 10,0 ml
de solução, tem uma pressão osmótica de 0,28 atm a 7O C.
Considerando a proteína como sendo um composto covalente típico, qual a sua
massa molecular? R:5,6x103
63.
Verifique se existe isotonia entre uma solução aquosa de NaCl 0,1M, à
temperatura de 27OC, e uma solução aquosa de sacarose 0,2M, à
mesma temperatura.
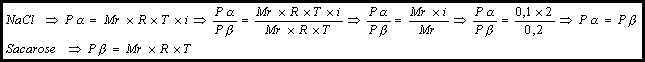
Cancelamos
Ta
e Tb
pois as duas soluções estão à mesma temperatura. Quantos aos fatores de Van’t
Hoff: na primeira solução (a),
como não foi dado o valor de a,
podemos supor o NaCl totalmente dissociado (a=100%)
e a segunda solução – solução molecular (i=1). Isso prova que as duas soluções
são isotônicas.
64.
Uma solução aquosa 0,28M de glicose é isotônica a uma solução
aquosa 0,10M de um cloreto de metal alcalino-terroso, na mesma temperatura.
Calcular o grau de dissociação aparente do sal. R=0,9 ou 90%
65.
Determinar a pressão osmótica, a 27O C, de uma solução
aquosa que, num volume de 2 litros, contém 12g de uréia. R: 2,46 atm.
66.
Uma solução que contém 90g de glicose num volume de 4,1 litros, a 27O
C, é isotônica a uma solução que contém 12g de uréia também a 27O
C. Calcular o volume da solução de uréia.R: 1,64L.
67.
Calcule a pressão osmótica, a 27O C, de uma solução que
contém 3,42g de sacarose (C12H22O11)
dissolvidos numa quantidade suficiente de água para 0,6L de solução. R: 0,41
68.
São dissolvidos 18g de glicose numa quantidade suficiente de água para
8,2L de solução. Essa solução, a 27O C, é
isotônica a uma solução de uréia cujo volume é de 6L. Calcule a massa de uréia.
R:4,4g
69.
Calcule a pressão osmótica, a 27O C, de uma solução 0,15M
de glicose - C6H12O6. R: 3,69
70.
A pressão osmótica de uma solução aquosa de uréia, a 27O
C, é de 6,15 atm. Determine a concentração molar dessa solução. R:0,25
71.
Uma solução não-eletrolítica apresenta, a 28O C, uma pressão
osmótica de 0,82 atm. Calcule o volume dessa solução que contém 1020
partículas de soluto. R:0,005L.
72.Uma
injeção endovenosa deve ser isotônica em relação ao sangue para não lisar
os glóbulos vermelhos. Se o sangue possui pressão osmótica igual a 7,65 atm a
37O C, calcule a massa de glicose (M=180) que deve ser utilizada para
preparar 10ml de uma injeção endovenosa. R: 0,54g
Relações entre os efeitos
coligativos verificados numa solução
v
Elevação
da temperatura de ebulição e abaixamento relativo da pressão máxima de
vapor:
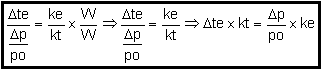 A
elevação da temperatura de ebulição de uma solução é diretamente
proporcional ao abaixamento relativo da pressão máxima de vapor (PMV)da mesma solução.
Isso significa que quanto maior é a elevação da temperatura de ebulição,
maior é o abaixamento relativo da pressão máxima de vapor
A
elevação da temperatura de ebulição de uma solução é diretamente
proporcional ao abaixamento relativo da pressão máxima de vapor (PMV)da mesma solução.
Isso significa que quanto maior é a elevação da temperatura de ebulição,
maior é o abaixamento relativo da pressão máxima de vapor
v
Abaixamento
da temperatura de congelamento e abaixamento relativo da pressão máxima de
vapor:
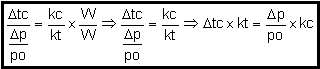 O
abaixamento da temperatura de congelamento de uma solução é diretamente
proporcional ao abaixamento relativo da pressão máxima de vapor (PMV) da mesma solução.
O
abaixamento da temperatura de congelamento de uma solução é diretamente
proporcional ao abaixamento relativo da pressão máxima de vapor (PMV) da mesma solução.
v
Elevação
da temperatura de ebulição e abaixamento da temperatura de congelamento:
A
elevação da temperatura de ebulição de uma solução é diretamente
proporcional ao abaixamento da temperatura de congelamento da mesma solução.
![]()
|
Quando
na mesma solução existem vários solutos, o efeito coligativo total é
igual à soma dos efeitos produzidos separadamente pelos solutos, como se
eles fossem dissolvidos separadamente na mesma quantidade de solvente. |
73. Uma
solução aquosa apresenta, num volume de 300 ml, 4g de NaOH e 1,17g de NaCl.
Admitindo os solutos 100%
dissociados, calcule a pressão osmótica dessa solução a 27OC.
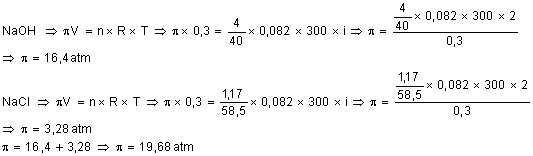
74.
Determine a temperatura de ebulição, sob pressão normal, de uma solução
que contém 2,00g de NaOH (a=100%)
e 1,42g de Na2SO4 (a=98%)
dissolvidos em 800g de água. Dado:
Ke=0,52OC/molal. R=100,08ºC
75.
Determinar a mínima temperatura possível de início de congelamento de
uma solução aquosa contendo 18,0g de glicose (M=180) e 9,50g de MgCl2
(cloreto de magnésio) (M=95), totalmente dissociado, em 500g de água. Dado:
Kc=1,86OC R=-1,488OC
76.
Uma solução contém 0,01 mol de sacarose (M=342) e 0,02 mol de sulfato
de sódio – Na2SO4 dissolvidos em 372g de água. Sabendo
que essa solução congela a –0,34OC, descubra o grau de dissociação
do sulfato de sódio nessa solução. Dado: Kc=1,86OC/molal.
R=95%
77.
Dadas as soluções aquosas:
I)
Glicose 0,5M
II)
Uréia 1,0M
III)
NaCl 0,5M (a=100%)
IV)
CaCl2 0,5M (a=100%)
a)Qual
delas entrará em ebulição sob uma temperatura maior?
b)coloque-as
em ordem crescente, de acordo com suas temperaturas de congelação.
c)Em
qual delas a pressão osmótica será maior?
|
Para
resolver o exercício, calcule o produto Mr.i. A solução com
maior valor de Mr.i terá ponto de ebulição maior, ponto de
congelação menor e maior pressão osmótica. Veja só: |
|||
|
Solução |
Mr |
i |
Mr.i |
|
Glicose |
0,5M |
1 |
0,5 |
|
Uréia |
1,0M |
1 |
1 |
|
NaCl |
0,5M
(a=100%) |
2 |
1 |
|
CaCl2 |
0,5M
(a=100%) |
3 |
1,5 |
a)
a solução IV terá efeitos coligativos mais intensos. Por exemplo,
maior ponto de ebulição;
b)
Quanto maior o produto Mr.i, mais intenso será o efeito crioscópico,
ou seja, menor o ponto de congelação da solução. Portanto, a ordem crescente
das temperaturas de congelação é: IV<III=II<I;
c)
Quanto maior o produto Mr.i, maior será a pressão osmótica.
Portanto, a solução IV terá a maior pressão osmótica.
***Pode-se
concluir que soluções com o mesmo produto Mr.i
possuirão efeitos coligativos de mesma intensidade. Assim, as soluções
II e III tem a mesma pressão de vapor, fervem e congelam na mesma temperatura e
possuem a mesma pressão osmótica (soluções isotônicas).
78.
Qual deverá ser a concentração molar de uma solução de cloreto de cálcio
– CaCl2 (a=100%)
tal que seja isotônica de uma
solução 0,9M de NaCl (a=100%)
na mesma temperatura?
|
CaCl2 a=100%; Mr=?; i=3 P=Mr.R.T.i P=Mr.R.T.3 |
|
|
NaCl a=100%; Mr=0,9M; i=2 P=Mr.R.T.i P=0,9.R.T.2 |